สารละลาย
สารละลายและความเข้มข้นของสารละลาย
สารละลาย
สารละลาย (Solution) หมายถึง สารเนื้อเดียวที่ไม่บริสุทธิ์ ซึ่งเกิดจากสารตั้งแต่ 2 ชนิดขึ้นไป รวมตัวเป็นเนื้อเดียวกัน ซึ่งสามารถจำแนกแบ่งออกได้เป็น 3 สถานะคือ คือ สารละลายของแข็ง สารละลายของเหลว และสารละลายแก๊ส
ความเข้มข้นของสารละลาย
ความเข้มข้นของสารละลายเป็นการบอกถึงอัตราส่วนปริมาณตัวถูกละลายกับปริมาณตัวทำละลายในสารละลายหนึ่ง ๆ อัตราส่วนดังกล่าวจะมีได้ 2 ลักษณะ คือ ปริมาณของตัวถูกละลายในสารละลายทั้งหมดกับปริมาณของตัวถูกละลายในตัวทำละลายทั้งหมด โดยมีหน่วยความเข้มข้น เป็นหน่วยที่ใช้บอกปริมาณของตัวถูกละลายและตัวทำละลายในสารละลาย โดยทั่วๆ ไปหน่วยความเข้มข้นของสารละลายมักจะบอกเป็นปริมาณของตัวถูกละลายในสารละลาย หน่วยต่างๆ ที่นิยมใช้กันในระดับนี้ได้แก่
1.หน่วยร้อยละ เป็นหน่วยของความเข้มข้นที่แบ่งย่อยออกเป็น 3 ประเภท
1.1 ร้อยละโดยมวลต่อมวล (%W/W) หรือเรียกย่อๆ ว่า ร้อยละโดยมวล (% by W) เป็นหน่วยความเข้มข้นที่ใช้ “บอกมวลของตัวถูกละลายในสารละลาย 100 หน่วยมวลเดียวกัน” เช่น สารละลายกรด HNO3 20% โดยมวล หมายความว่า ในสารละลายกรด 100 กรัม มีเนื้อกรด HNO3 20 กรัม หรือในสารละลายกรด 100 กิโลกรัม มีเนื้อกรด มีเนื้อกรด HNO3 20 กิโลกรัม (มวลของตัวถูกละลายและมวลของสารละลาย จะต้องเป็นหน่วยเดียวกัน) สารละลาย NH3 30% โดยมวล หมายความว่า สารละลาย 100กรัมมี NH3 ละลายอยู่ 30 กรัม เป็นต้น
1.2 ร้อยละโดยปริมาตรต่อปริมาตร (%V/V) หรือเรียกย่อๆ ว่า ร้อยละโดยปริมาตร (% by V) เป็นหน่วยที่ใช้บอก “ปริมาตรของตัวถูกละลายในสารละลาย 100 หน่วยปริมาตรเดียวกัน” เช่น สารละลายกรด HNO3 50% โดยปริมาตร หมายความว่า ในสารละลาย 100 cm3 มีเนื้อกรด HNO3 50 cm3 หรือในสารละลายกรด 100 ลิตร มีเนื้อกรด NHO3 50 ลิตร สารละลาย NH3 20% โดยปริมาตร หมายความว่า ในสารละลาย 100 cm3 มี NH3 ละลายอยู่ 20 cm3
1.3 ร้อยละโดยมวลต่อปริมาตร(% W/V) เป็นหน่วยที่ใช้บอก “มวลของตัวถูกละลายในสารละลาย 100 หน่วยปริมาตร” หน่วยของมวลและปริมาตรจะต้องสอดคล้องกัน คือ ถ้ามวลเป็นกรัม ปริมาตรจะเป็นลูกบาศก์เซนติเมตร (cm3) หรือถ้ามวลเป็นกิโลกรัม ปริมาตรจะเป็นลิตร เช่น สารละลายกรด HNO3 25% W/V หมายความว่า ในสารละลาย 100 cm3 มีเนื้อกรด HNO3 ละลายอยู่ 25 กรัม หรือในสารละลายกรด 100 ลิตร มีเนื้อกรด NHO3 ละลายอยู่ 25 กิโลกรัม สารละลาย NH3 30% โดยมวล/ปริมาตร หมายความว่า สารละลาย 100 cm3 มี NH3 ละลายอยู่ 30 กรัม

ภาพสารละลาย
ที่มา https://pixabay.com/th , PublicDomainPictures
การคำนวณหน่วยร้อยละของสารละลาย
หน่วยร้อยละของสารละลายสามารถนำมาสรุปเป็นสูตร สำหรับการคำนวณได้ดังนี้
% โดยมวล = (มวลของตัวละลาย/มวลสารละลาย)x100
% โดยปริมาตร = (ปริมาตรของตัวละลาย/ปริมาตรสารละลาย)x100
% โดยมวล/ปริมาตร = (มวลของตัวละลาย/ปริมาตรสารละลาย)x100
หมายเหตุ บางครั้งโจทย์อาจจะไม่กำหนดหน่วยร้อยละ ว่าเป็นประเภทใด โดยทั่วๆ ไปให้เข้าใจดังนี้
กรณีที่ 1 สารละลายของแข็งในของเหลว จะเป็น % โดยมวล/ปริมาตร
กรณีที่ 2 สารละลายของของเหลวในของเหลว หรือ ก๊าซจะเป็น % โดยปริมาตร
2. โมล/ลูกบาศก์เดซิเมตร (mol/dm3) หรือโมลาริตี เป็นหน่วยความเข้มข้นในระบบเอสไอ สามารถใช้ โมล/ลิตร (mol/l) แทนได้ หน่วยโมล/ลิตร เดิมเรียกว่า โมลาร์ (molar) ใช้สัญลักษณ์เป็น “M” โมล/ลิตร เป็นหน่วยความเข้มข้นที่แสดง “จำนวนโมลของตัวถูกละลายในสารละลาย 1 ลูกบาศก์เดซิเมตร (1 ลิตร)” เช่น สารละลายกรด HNO3 0.5 โมล/ลิตร หมายความว่าในสารละลาย 1 ลิตร มีเนื้อกรด HNO3 ละลายอยู่ 0.5 โมล สารละลาย NH3 0.1 โมล/ลิตร หมายความว่า ในสารละลาย 1 ลิตร มี NH3 ละลายอยู่ 0.1 โมล
3. โมล/กิโลกรัม (mol/kg) หรือ โมแลลิตี (molality) เป็นหน่วยความเข้มข้นที่ใช้บอก “จำนวนโมลของตัวถูกละลายที่มีอยู่ในตัวทำละลาย 1 กิโลกรัม หรือ 100 กรัม” จึงมีหน่วยเป็นโมลต่อกิโลกรัม หรือเรียกว่า โมแลล ใช้สัญลักษณ์เป็น “m” เช่น สารละลายกรด HNO3 0.5 โมล/กิโลกรัม หมายความว่าในน้ำ 1 กิโลกรัม มีกรด HNO3 ละลายอยู่ 0.5 โมล สารละลาย NH3 0.2 โมล/กิโลกรัม หมายความว่าในน้ำ 1 กิโลกรัม มี NH3 ละลายอยู่ 0.2 โมล
4. เศษส่วนโมล (mole fraction) เป็นหน่วยความเข้มข้นของสารละลายอีกชนิดหนึ่งมักจะใช้สัญลักษณ์เป็น ” x ” เศษส่วนโมล หมายถึง อัตราส่วนระหว่างจำนวนโมลของสารต่อจำนวนโมลของสารทั้งหมด เศษส่วนโมลของตัวทำละลาย จึงหมายถึงอัตราส่วนระหว่างจำนวนโมลของตัวทำละลายต่อจำนวนโมลของสารละลาย เศษส่วนโมลของตัวถูกละลาย จึงหมายถึง อัตราส่วนระหว่างจำนวนโมลของตัวถูกละลายต่อจำนวนโมลของสารละลาย อาจจะเขียนเป็นสูตรแสดงความสัมพันธ์ของเศษส่วนโมลได้ดังนี้
เศษส่วนโมล A = โมลของสาร A / จำนวนโมลรวม
เช่น สารละลายชนิดหนึ่งประกอบด้วยสาร A n1 โมล และสาร B n2 โมล
จำนวนโมลรวม = n1 + n2
เศษส่วนโมลของ A (x1) = n1/(n1+n2)
เศษส่วนโมลของ B (x2) = n2/(n1+n2)
เศษส่วนโมลของสารแต่ละชนิดจะต้องมีค่าน้อยกว่า 1 เสมอ ไม่ว่าจะเป็นสารละลายที่เกิดจากสารกี่ชนิดรวมกันก็ตาม ผลบวกของเศษส่วนโมลของสารทั้งหมดรวมกันจะต้องเป็น 1 เสมอ
∑ xi = x1 + x2 + x3 + ……. = 1
เช่น สารละลายกรด HNO3 มีเศษส่วนโมลของกรด HNO3 เท่ากับ 0.2 หมายความว่า ในสารละลาย 1 โมล จะมีกรด HNO3 0.2 โมล และมีน้ำ 0.8 โมล
เศษส่วนโมล สามารถเปลี่ยนเป็นร้อยละโดยมวล (% mol) ได้โดยอาศัยความสัมพันธ์ดังนี้
ร้อยละโดยมวล = เศษส่วนโมล x 100
5. ส่วนในล้านส่วน (part per million) ใช้สัญลักษณ์ “ppm” เป็นหน่วยที่ใช้ในกรณีที่สารมีจำนวนน้อยๆ ซึ่งใช้อยู่ในรูป
5.1 หน่วยส่วนในล้านส่วนโดยมวลต่อมวล ซึ่งหมายถึง มวลของตัวถูกละลายที่มีอยู่ในสารละลาย 1 ล้านหน่วยมวลเดียวกัน เช่น mg/kg หรือ μ g/kg
5.2 หน่วยส่วนในล้านส่วนโดยมวลต่อปริมาตร ซึ่งหมายถึง มวลของตัวถูกละลายที่มีอยู่ใน 1 ล้านหน่วยปริมาตร เช่น มิลลิกรัมต่อลูกบาศก์เดซิเมตร เช่น น้ำในแม่น้ำเจ้าพระยามีปรอท 1 ppm อาจหมายความว่า ในน้ำ 1 ล้านมิลลิกรัม (1 กิโลกรัม) มีปรอทละลายอยู่ 1 มิลลิกรัม หรือ หมายความว่า ในน้ำ 1 ล้านมิลลิลิตร (1 ลิตร) มีปรอทละลายอยู่ 1 มิลลิกรัม
นอกจากจะบอกความเข้มข้นของสารละลายในหน่วยต่างๆ ดังที่กล่าวมาแล้ว ในบางครั้งยังมีการบอกหน่วยความเข้มข้นในเชิงเปรียบเทียบ เช่น
- ถ้าสารละลายมีตัวถูกละลายอยู่น้อย เรียกว่า สารละลายเจือจาง
-
ถ้าสารละลายมีตัวถูกละลายอยู่มาก เรียกว่า สารละลายเข้มข้น
- ถ้าสารละลายมีตัวถูกละลายอยู่มากจนอิ่มตัว เรียกว่า สารละลายอิ่มตัว เป็นต้น
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 2 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
นางสาววนิดา สวนดอกไม้. เอกสารประกอบการสอนชุด สารละลาย. สืบค้นเมื่อ 27 มกราคม 2563.จาก http://www.sysp.ac.th/files/20140001_18072512125446.pdf
กลับไปที่เนื้อหา
การเตรียมสารละลาย
การเตรียมสารละลาย คือการนำตัวถูกละลายมาเติมตัวทำละลายให้มีความเข้มข้นและปริมาตรตามที่ต้องการ อาจจะเตรียมได้หลายวิธี ดังนี้
วิธีที่ 1 การเตรียมสารละลายจากสารบริสุทธิ์
เป็นการเตรียมสารละลายจากสารบริสุทธิ์ โดยการนำสารบริสุทธิ์ เช่น ของแข็ง ของเหลว และก๊าซ ละลายในตัวทำละลาย ซึ่งอาจจะทำได้โดยการชั่งสารบริสุทธิ์แล้วนำมาละลายในตัวทำละลาย โดยการคำนวณล่วงหน้าว่าถ้าต้องการเตรียมสารละลายที่มีความเข้มข้นและปริมาตรตามต้องการ จะต้องชั่งสารหนักกี่กรัม การชั่งสารจะต้องใช้เครื่องชั่งอย่างละเอียด นำสารที่ชั่งแล้วเทใส่ขวดวัดปริมาตรที่เตรียมไว้ แล้วเติมน้ำลงไปจนถึงขีดบอกปริมาตร จะได้สารละลายที่มีความเข้มข้นตามต้องการ
การเตรียมสารละลายแบบนี้ เทคนิคส่วนใหญ่จะอยู่ที่การชั่งน้ำหนักสารและการวัดปริมาตรสารละลาย ดังนั้น สารละลายที่เตรียมได้จะมีความเข้มข้นถูกต้องมากน้อยเพียงใดขึ้นอยู่กับหลักการดังนี้
-
การเตรียมสารละลายจากของแข็ง ส่วนใหญ่จะใช้วิธีการชั่งของแข็ง แล้วนำไปละลายในตัวทำละลาย
-
การเตรียมสารละลายจากของเหลว อาจจะใช้วิธีการชั่งน้ำหนัก หรือใช้วัดปริมาตรของของเหลว ซึ่งจะต้องคำนวณออกมาเป็นน้ำหนัก โดยใช้ความหนาแน่นเข้าช่วย
-
การเตรียมสารละลายจากก๊าซ ส่วนใหญ่จะใช้วิธีการวัดปริมาตร เมื่อละลายในน้ำ หรือในตัวทำละลาย จะได้สารละลายตามต้องการ
-
การคำนวณเกี่ยวกับการเตรียมสารละลายอาศัยหลักการที่ว่า “เมื่อนำสารบริสุทธิ์ (ของแข็ง ของเหลว หรือก๊าซ) มาละลายในน้ำ มวลของสารในขณะที่เป็นสารบริสุทธิ์ ย่อมเท่ากับมวลของสารในขณะที่อยู่ในสารละลาย”
ในแง่ของโมล “จำนวนโมลของสารที่เป็นสารบริสุทธิ์ ย่อมเท่ากับจำนวนโมลของสารที่เป็นสารละลาย”
โมลสารบริสุทธิ์ = โมลของสารละลาย
W/M = VC/1000
w = มวลของสารบริสุทธิ์ (ตัวถูกละลาย) เป็นกรัม
M = มวลโมเลกุลของตัวถูกละลาย
V = ปริมาตรของสารละลายเป็น cm3
C = ความเข้มข้นของสารละลายเป็น mol/dm3
สูตรนี้สามารถใช้คำนวณเกี่ยวกับการเตรียมสารละลายได้โดยตรง พิจารณาจากสูตรพบว่ามีตัวแปร 3 ตัว คือ w, V และ C ซึ่งการคำนวณโดยทั่วๆ ไปโจทย์จะกำหนดตัวแปรให้ 2 ตัว แล้วถามตัวที่ 3 เช่น กำหนด w, V และถาม C หรือกำหนด w, V ถาม C เป็นต้น
การกำหนดมวล (w) ของสารบางครั้งอาจจะกำหนดให้ทางอ้อม เช่น กำหนดผ่านปฏิกิริยาเคมี กำหนดผ่านความหนาแน่นและปริมาตร (ในกรณีของเหลว)
w = ปริมาตร x ความหนาแน่น
ตัวอย่างที่ 1 ถ้าต้องการสารละลายโพแทสเซียมไอโอไดด์ (KI) เข้มข้น 0.2 โมล/ลิตร จำนวน 200 cm3 จะต้องใช้ KI กี่กรัม
วิธีทำ จากสูตร
โมลสารบริสุทธิ์ = โมลของสารละลาย
W/M = VC/1000
w = มวลของ KI กรัม
M = มวลโมเลกุลของ KI = 166
V = ปริมาตรของสารละลาย= 200 cm3
C = ความเข้มข้นของสารละลายเป็น 0.2 mol/dm3
w/166 = (200x0.2)/1000
w = 6.64 กรัม
จะต้องใช้ KI 6.64 กรัม
วิธีที่ 2 การเตรียมสารละลายโดยการทำให้เจือจาง
ทำได้โดยนำสารละลายที่ทราบความเข้มข้นที่แน่นอนแล้วมาเติมน้ำให้เจือจางลงให้ได้ความเข้มข้นใหม่ ปกติต้องคำนวณปริมาตรของสารละลายเข้มข้นล่วงหน้าเช่นเดียวกับกรณีชั่งน้ำหนัก หลังจากคำนวณหาปริมาตรที่ต้องการแล้ว จึงใช้ปิเปตดูดสารละลายขึ้นมา นำไปถ่ายลงในขวดวัดปริมาตรที่เตรียมไว้ แล้วเติมน้ำจนถึงขีดบอกปริมาตร จะได้สารละลายที่มีความเข้มข้นใหม่ตามต้องการ
จะเห็นได้ว่าการเตรียมสารละลายโดยการทำให้เจือจางนั้น เทคนิคต่างๆ จะอยู่ที่การใช้ปิเปตดูดสารละลายเข้มข้นขึ้นมาและการวัดปริมาตรในขวดวัดปริมาตร ดังนั้นสารละลายที่ได้จะมีความเข้มข้นถูกต้องเพียงใดก็ขึ้นอยู่กับขั้นตอนดังกล่าว
การคำนวณเกี่ยวกับการเจือจางอาศัยหลักการที่ว่า “เมื่อเติมน้ำลงไปในสารละลาย จะทำให้ปริมาตรและความเข้มข้นของสารละลายเปลี่ยนแปลงไป แต่จำนวนโมลของสาร (ตัวถูกละลาย)จะเท่าเดิม”
จำนวนโมลก่อนเติมน้ำ = จำนวนโมลหลังเติมน้ำ
V1C1 = V2C2
และ V α 1/C
หมายความว่า ถ้าปริมาตรของสารละลายเพิ่มขึ้น (V) ความเข้มข้น (C) ของสารละลายจะลดลง “ยิ่งมีปริมาตรเพิ่มขึ้นเท่าใด ความเข้มข้นก็จะยิ่งลดลงเท่านั้น” เช่น ถ้าเติมน้ำลงไปจนปริมาตรของสารละลายเป็น 10 เท่าของตอนแรก ความเข้มข้นจะลดลงเหลือ 1/10 เท่าของตอนแรก
ในทางกลับกัน ถ้าต้องการให้สารละลายมีความเข้มข้นเพิ่มมากขึ้น ก็อาจจะทำได้โดยการนำสารละลายไปเคี่ยวให้น้ำระเหยไปบางส่วน ซึ่งการคำนวณก็ใช้หลักการในทำนองเดียวกัน คือ จำนวนโมลของสารก่อนนำไปเคี่ยวและจำนวนโมลของสารหลังจากนำไปเคี่ยวแล้วจะต้องเท่ากัน
พิจารณาตัวอย่างเกี่ยวกับการเจือจางสารละลายต่อไปนี้
ตัวอย่างที่ 2 ถ้านำสารละลาย HCl 1.0 โมล/ลิตร มา 20 cm3 แล้วเติมนำจนมีปริมาตรเป็น 300 cm3 จะได้สารละลายเข้มข้นกี่โมล/ลิตร
วิธีทำ
โมลก่อนเจือจาง = โมลหลังเจือจาง
V1C1 = V2C2
V1 = 20 cm3
V2 = 300 cm3
C1 = 1.0 โมล/ลิตร
C2 = ? โมล/ลิตร
แทนค่าจะได้
20 x 1.0 = 300 x C2
C2 = 0.067 โมล/ลิตร
จะได้สารละลายเข้มข้น 0.067 โมล/ลิตร
วิธีที่ 3 การเตรียมสารละลายโดยการผสมสารละลายเข้าด้วยกัน
ใช้หลักการที่ว่า เมื่อนำสารละลายชนิดเดียวกันที่มีความเข้มข้นต่างๆ กัน มาผสมกัน “จำนวนโมลของตัวถูกละลายก่อนผสมกัน ย่อมเท่ากับจำนวนโมลของตัวถูกละลายหลังผสมกัน”
-
จำนวนโมลของตัวถูกละลายแต่ละความเข้มข้นคิดได้จาก n = VC/1000
-
จำนวนโมลของตัวถูกละลายก่อนผสมคิดจาก V และ C ของแต่ละความเข้มข้น
-
จำนวนโมลของตัวถูกละลายภายหลังผสมคิดจาก V รวม และ C รวม
เช่น ผสมสารละลายกรดที่มีปริมาตรและความเข้มข้นต่างๆ กันดังนี้
โมลก่อนผสม = โมลหลังผสม
n1 + n2 = n
V1C1 + V2C2 = VC
เมื่อ V = ปริมาตรรวม = V1 + V2 + ….
หน่วย V, V1 , V2 , … เป็นหน่วยปริมาตรอย่างไรก็ได้แต่ต้องเป็นหน่วยเดียวกัน
ตัวอย่างที่ 3 เมื่อผสมสารละลาย NaCl เข้มข้น 0.1 , 0.2, และ 0.5 mol/dm3 จำนวน 100 , 200 และ 300 cm3 ตามลำดับ จะได้สารละลายรวมที่มีความเข้มข้นเป็นกี่ mol/dm3
วิธีทำ
V1 = 100 V2 = 200 V3 = 300 V = V1 + V2 + V3
C1 = 0.1 C2 = 0.2 C3 = 0.5 V = 600
โมลก่อนผสม = โมลหลังผสม
n1 + n2 + n3 = n
V1C1 + V2C2 + V2C3 = VC
(100 x 0.1) + (200 x 0.2) + (300 x 0.5) = 600 x C
C = 0.33 mol/dm3
ได้สารละลายเข้มข้น 0.33 mol/dm3
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 2 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
กลับไปที่เนื้อหา
สมบัติบางประการของสารละลาย
สมบัติคอลลิเกตีฟ หมายถึง สมบัติทางกายภาพของสารละลายที่ขึ้นอยู่กับจำนวนอนุภาคของตัวถูกละลาย โดยไม่ขึ้นอยู่กับชนิดของตัวถูกละลาย หมายความว่า ถ้าสารละลายนั้นมีความเข้มข้นของตัวถูกละลายเท่ากัน จะต้องมีสมบัติคอลลิเกตีฟเท่ากัน สมบัติคอลลิเกตีฟได้แก่ ความดันที่ลดลง จุดเดือดที่เพิ่มขึ้น จุดเยือกแข็งที่ลดลง และความดันออสโมซิส (osmotic pessure)สมบัติคอลลิเกตีฟ จะใช้ได้ดีกับตัวถูกละลายที่ระเหยยาก และไม่แตกตัวเป็นไอออน สารละลายที่มีตัวทำละลายชนิดเดียวกัน ถ้ามีความเข้มข้นของตัวถูกละลาย (ชนิดระเหยยากและไม่แตกตัวเป็นไออน) เป็น mol/kg เท่ากัน จะมีจุดเดือดและจุดหลอมเหลว ซึ่งเป็นสมบัติคอลลิเกตีฟเท่ากัน ตัวอย่างเช่น เมื่อละลายกลูโคส 1 โมล ในน้ำ 1000 กรัม จะทำให้สารละลายมีจุดเดือดเพิ่มขึ้น 0.51 0C (เดือดที่ 100.51 0C) และจุดเยือกแข็งลดลง 1.86 0C (จุดเยือกแข็งเท่ากับ -1.86 0C ) ในทำนองเดียวกัน เมื่อนำซูโครส 1 โมล ในน้ำ 1000 กรัม จะได้สารละลายมีจุดเดือดเพิ่มขึ้น 0.51 0C (เดือดที่ 100.51 0C) และจุดเยือกแข็งลดลง 1.86 0C (จุดเยือกแข็งเท่ากับ -1.86 0C ) เช่นเดียวกับกลูโคส ทั้งนี้เพราะสมบัติคอลลิเกตีฟของสารละลายขึ้นอยู่กับธรรมชาติของตัวทำละลาย แต่ไม่ขึ้นอยู่กับธรรมชาติของตัวถูกละลาย ขึ้นอยู่กับปริมาณของตัวถูกละลาย แต่ไม่ขึ้นกับชนิดของตัวถูกละลาย
อย่างไรก็ตาม ถ้าใช้สารละลายที่มีความเข้มข้นต่างกัน แม้ว่าจะมีตัวทำละลายชนิดเดียวกัน จุดเดือดและจุดหลอมเหลวจะไม่เท่ากัน เช่น ถ้าเพิ่มความเข้มข้นของกลูโคสเป็น 2 โมล ในน้ำ 1000 กรัม จะได้สารละลายที่มีจุดเยือกแข็งเป็น -3.72 0C และมีจุดเดือดเป็น 100.02 0C เป็นต้น ถ้าใช้ความเข้มข้นของตัวถูกละลายเท่ากัน แต่ใช้ตัวทำละลายต่างกันก็จะได้จุดเดือดและจุดเยือกแข็งไม่เท่ากัน กล่าวโดยสรุป คือ “จุดเดือดและจุดเยือกแข็งของสารละลายที่มีตัวทำละลายชนิดเดียวกันจะไม่ขึ้นอยู่กับชนิดของตัวถูละลาย แต่จะขึ้นอยู่กับปริมาณ (จำนวนโมล) ของตัวถูกละลาย” ตัวอย่างเช่น เบนซีน มีจุดเดือด 80.10 0C มีจุดเยือกแข็ง 5.50 0C ถ้านำตัวถูกละลายใดๆ เช่น โทลูอีน, แนพธาลีน, ฯลฯ จำนวน 1 โมล ใส่ในเบนซีน 1 กิโลกรัม ทำให้ได้สารละลายเข้มข้น 1 โมลต่อกิโลกรัม (หรือ 1 โมแลล) จะทำให้สารละลายมีจุดเดือดเป็น 82.63 0C (จุดเดือดเพิ่มขึ้น 2.53 0C เท่ากัน) และมีจุดเยือกแข็ง 0.60 0C (จุดเยือกแข็งลดลง 4.90 0C เท่ากัน) หรือสารละลายที่มีกรดอะซิติกเป็นตัวทำละลายและมีความเข้มข้น 1 โมล/กิโลกรัม จะมีจุดเดือด 120.97 0C (เพิ่มขึ้น 3.07 0C) และจุดเยือกแข็ง 12.7 0C (ลดลง 3.90 0C) เสมอ ไม่ว่าตัวถูกละลายจะเป็นสารใด
ค่าคงที่ของการเพิ่มของจุดเดือด (molal boiling point elevation constant)
ค่าคงที่ของการเพิ่มของจุดเดือด ใช้สัญลักษณ์เป็น Kb เนื่องจากจุดเดือดของสารละลายที่เข้มข้นเท่ากันจะเพิ่มขึ้นเท่ากันและเป็นค่าคงที่สำหรับตัวทำละลายชนิดหนึ่งๆ จึงได้มีการกำหนดค่าคงที่ขึ้นมาเรียกว่า ค่าคงที่ของการเพิ่มของจุดเดือด ซึ่งหมายถึง “ผลต่างระหว่างจุดเดือดของสาระละลายที่มีความเข้มข้น 1 โมล/กิโลกรัม กับจุดเดือดของตัวทำละลายบริสุทธิ์” หรือหมายถึง “จุดเดือดที่เพิ่มขึ้นของสารละลายเข้มข้น 1 โมล/กิโลกรัม”
Kb = จุดเดือด(ของสารละลาย 1 mol/kg) - จุดเดือด (ตัวทำละลาย)
ค่าคงที่ของการลดของจุดเยือกแข็ง (molal freezing point depression constant)
ใช้สัญลักษณ์ Kf ซึ่งมีความหมายในทำนองเดียวกับ Kb ของจุดเดือด คือ หมายถึง “ผลต่างระหว่างจุดเยือกแข็งของตัวทำละลายบริสุทธิ์กับจุดเยือกแข็งของสารละลายที่มีความเข้มข้น 1 โมล/กิโลกรัม” ซึ่งมีค่าคงที่ หรือ หมายถึง “จุดเยือกแข็งที่ลดลงของสารละลายที่มีตัวถูกละลายเข้มข้น 1 โมล/กิโลกรัม”
Kf = จุดเยือกแข็ง(ตัวทำละลาย) - จุดเยือกแข็ง (สารละลาย 1 mol/kg)
ค่า Kb และ Kf เป็นค่าคงที่เฉพาะตัวของตัวทำละลายชนิดหนึ่งๆ ขึ้นอยู่กับธรรมชาติของตัวทำละลายเท่านั้น ไม่เกี่ยวข้องกับตัวถูกละลาย
ตารางที่ 1 จุดเดือด, Kb , จุดเยือกแข็งและ Kf ของตัวทำละลายบางชนิด
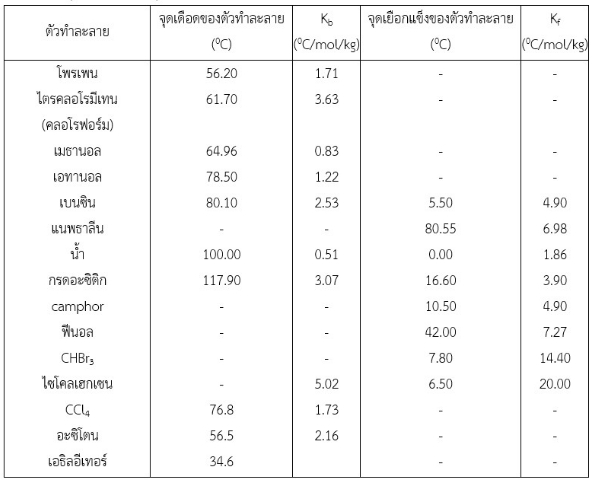
ก. การคำนวณเกี่ยวกับจุดเยือกแข็งที่ลดลง
พิจารณาจุดเยือกแข็งที่ลดลง (ΔTf) ของสารละลายยูเรียในน้ำดังต่อไปนี้
ตารางที่ 2 ความสัมพันธ์ระหว่างจุดเยือกแข็งที่ลดลงกับความเข้มข้นของสารละลายยูเรีย
|
ความเข้มข้น (mol/kg) |
ΔTf (0C) |
ความเข้มข้น (mol/kg) |
ΔTf (0C) |
|
0.004235 0.007645 0.012918 |
0.007846 0.01413 0.02393 |
0.01887 0.03084 0.04248 |
0.03496 0.05696 0.07850 |
จะเห็นได้ว่า เมื่อความเข้มข้นของสารละลายเพิ่มขึ้น จุดเยือกแข็งของสารละลายจะลดลงมากขึ้น จึงนำมาสรุปได้ว่า
“จุดเยือกแข็งที่ลดลงของสารละลายจะแปรผันโดยตรงกับปริมาณ (ความเข้มข้น) ของตัวถูกละลาย”
ถ้า ΔTf = จุดเยือกแข็งของสารละลายที่ลดลง
= จุดเยือกแข็งของตัวทำละลาย - จุดเยือกแข็งของสารละลาย
m = ความเข้มข้นของสารละลายเป็น mol/kg หรือ molal
จะได้ ΔTf m
หรือ
ΔTf = Kfm
ซึ่ง Kf = ค่าคงที่ของการลดของจุดเยือกแข็ง
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 2 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
กลับไปที่เนื้อหา



