สารประกอบไอออนิก
สารประกอบไอออนิก ( Ionic Compounds ) หมายถึง สารประกอบที่ประกอบด้วยธาตุโลหะและธาตุอโลหะ ธาตุที่เป็นโลหะเป็นไอออนบวก ส่วนธาตุที่เป็นอโลหะเป็นไอออนลบ ยึดกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้า เรียกว่า พันธะไอออนิก
พันธะไอออนิก ( Ionic bond ) เป็นแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก โลหะส่วนใหญ่มีค่าอิเล็กโตรเนกาติวิตีต่ำจึงเสียอิเล็กตรอนให้แก่อะตอมของอโลหะซึ่งมีค่าอิเล็กโตรเนกาติวิตีสูง และทำให้อิเล็กตรอนที่อยู่รอบ ๆ อะตอมครบ 8 ( octat rule ) โลหะกลายเป็นไอออนบวก และอโลหะกลายเป็นไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น โดยแรงดึงดูดจะแปรผันโดยตรงกับจำนวนประจุบวกและลบของไอออนทั้งสองที่ยึดติดกัน ดังนั้นค่าประจุยิ่งมาก แรงดึงดูดยิ่งมาก พันธะยิ่งแข็งแรง และแรงดึงดูดจะแปรผกผันกับระยะทางระหว่างไอออนทั้งสอง ไอออนบวกและไอออนลบอยู่ห่างกันมาก แรงดึงดูดจะน้อยลง
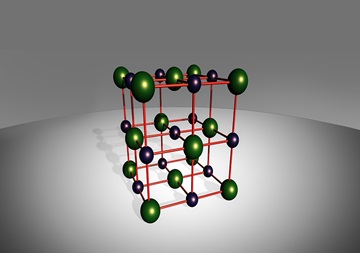
ภาพที่ 1 แสดงโครงสร้างผลึกของ Nacl (สารประกอบไอออนิกชนิดหนึ่ง)
ที่มา : https://pixabay.com, TPHeinz
หลักการเขียนสูตรสารประกอบไอออนิก
-
พิจารณาว่าสารประกอบนั้นประกอบด้วยธาตุชนิดใด
-
ธาตุโลหะหมู่ 1-12 มักเป็นไอออนบวก
-
ธาตุอโลหะหมู่ 16-17 มักเป็นไอออนลบ
-
ธาตุในหมู่ 13-15 อาจเป็นไอออนลบหรือไอออนบวกก็ได้ขึ้นอยู่กับชนิดของสาร
-
ไอออนบวกหรือไอออนลบ อาจเป็น ไอออนของธาตุเดี่ยว เช่น Na+, Br-, Mg2+, Cl- หรือกลุ่มอะตอมก็ได้ เช่น NH4+, NO3-
ภาพที่ 2 แสดงธาตุในหมู่และคาบต่าง ๆ
ที่มา : https://th.wikipedia.org/wiki/ตารางธาตุ
-
เขียนสัญลักษณ์ของธาตุหรือกลุ่มอะตอมที่เป็นไอออนบวก ตามด้วยสัญลักษณ์ของธาตุหรือกลุ่มอะตอมที่เป็นไอออนลบเสมอ โดยเขียนไอออนบวกและลบติดกัน และไม่ต้องเขียนแสดงประจุของไอออน เช่น KBr, BaCl2, NH4NO3, NaCl
-
พิจารณาประจุของไอออนบวกและไอออนลบ โดยประจุรวมของสารประกอบต้องเป็น “ศูนย์” โดยห้อยท้ายสัญลักษณ์ของสัดส่วนไอออนบวกและไอออนลบที่ทำให้ประจุรวมเป็นศูนย์ด้วยเลขอาระบิก
ตัวอย่างเช่น แมกนีเซียมคลอไรด์ ( Magnesium Chloride ) ประกอบด้วยธาตุแมกนีเซียม ( Mg ) และ คลอรีน ( Cl ) ไอออนแมกนีเซียมมีประจุ +2 ไอออนของคลอไรด์มีประจุ -1 และผลรวมของประจุจะต้องเป็นศูนย์ ดังนั้น สัดส่วน แมกนีเซียม : คลอไรด์ คือ 1 : 2 เพราะฉะนั้นสูตรของแมกนีเซียมคลอไรด์ คือ MgCl2
หลักการเรียกชื่อสารประกอบไอออนิก
-
เรียกชื่อไอออนบวกตามด้วยไอออนลบ
-
เรียกไออนบวกที่เป็นไอออนของอะตอมเดี่ยวตามชื่อของธาตุนั้น เช่น Ca2+ อ่านว่า แคลเซียม
Na+ อ่านว่า โซเดียม Al3+ อ่านว่า อลูมิเนียม H+ อ่านว่า ไฮโดรเจน Ag+ อ่านว่า ซิลเวอร์ เป็นต้น
- ไอออนบวกของโลหะทรานสิชันที่มีเลขออกซิเดชันหลายค่า จะเขียนชื่อธาตุ ตามด้วยเลขออกซิเดชันเป็นเลขโรมันในเครื่องหมายวงเล็บ และให้เรียกชื่อด้วยภาษากรีก ( ถ้ามี ) แล้วลงท้ายไอออนที่มีเลขออกซิเดชันมากด้วย “อิก ( - ic )” และลงท้ายไอออนที่มีเลขออกซิเดชันน้อยด้วย “อัส ( - ous )” เช่น
ตัวอย่างที่ 1
Fe มีชื่อภาษากรีก คือ เฟอร์รัม ( Ferrum ) มีเลขออกซิเดชัน 2 ค่า คือ +2 และ +3
Fe (II) หรือ iron (II) เรียกว่า เฟอร์รัส ( ferrous )
ส่วน Fe (III) หรือ iron (III) เรียกว่า เฟอร์ริก ( ferric )
ตัวอย่างที่ 2
Hg มีเลขออกซิเดชัน 2 ค่า คือ +1 และ +2
Hg (I) หรือ mercury (I) เรียกว่า เมอร์คิวรัส ( mercurous )
ส่วน Hg (II) หรือ mercury (II) เรียกว่า เมอร์คิวริก ( mercurous )
- เรียกไอออนบวกที่มาจากกลุ่มอะตอมหรือโมเลกุลคล้ายชื่อเดิม แต่งท้ายสียงด้วย “เนียม ( - nium )” เช่น NH4+ เรียกว่า แอมโมเนียม PH4+ เรียกว่า ฟอสโฟเนียม เป็นต้น
- ไอออนลบส่วนใหญ่เรียกชื่อโดยเปลี่ยนท้ายชื่อภาษาอังกฤษเป็น “-ไอด์ ( - ide )” หรือบางชนิดเป็น “ –เอต ( - ate )” ตัวอย่างเช่น
H- เรียกว่า ไฮไดรด์ / hydride F- เรียกว่า ฟลูออไรด์ / fluoride
Cl- เรียกว่า คลอไรด์ / Chloride Br- เรียกว่า โบรไมด์ / bromide
I- เรียกว่า ไอโอไดด์ / iodide P 3- เรียกว่า ฟอสไฟด์ / phosphide
SCN- เรียกว่า ไทโอไซยาเนต / thiocyanate NO3- เรียกว่า ไนเทรต / nitrate
NCS- เรียกว่า ไอโซไทโอไซยาเนต / isothiocyanate NO2- เรียกว่า ไนไทรต์ / nitrite
ตัวอย่างการเรียกชื่อสารประกอบไอออนิกบางชนิด
NaCl โซเดียมคลอไรด์
BaBr2 แบเรียมโบรไมด์
KMnO4 โพแทสเซียมเปอร์แมงกาเนต
CaC2O4 แคลเซียมออกซาเลต
NaHCO3 โซเดียมไฮโดรเจนคาร์บอเนต หรือ โซเดียมไบคาร์บอเนต
(NH4)2SO4 แอมโมเนียมซัลเฟต
Co (NO3)3 โคบอลต์ (III) ไนเทรต
Co (NO3)2 โคบอลต์ (II) ไนเทรต
Fe2O3 เฟอร์ริกออกไซด์ หรือ เหล็ก (III) ออกไซด์
สมบัติสารประกอบไอออนิก
-
เมื่อเป็นของแข็งสามารถนำไฟฟ้าได้น้อยมาก แต่การนำไฟฟ้าจะดีขึ้นเมื่อหลอมเหลวหรือเมื่อเป็นสารละลาย เนื่องจากในสถานะของแข็งไอออนต่าง ๆ ซึ่งมีประจุไฟฟ้าจะถูกยึดเหนี่ยวกันอย่างเหนียวแน่น แต่เมื่อนำไปหลอมเหลวหรือนำไปละลายน้ำ โครงผลึกจะหลุดออกเสียสภาพไปทำให้ไอออนสามารถเคลื่อนที่ไปมาได้ สารประกอบไอออนิกจึงสามารถนำไฟฟ้าได้
-
มีลักษณะแข็งแต่เปราะ ส่วนใหญ่เป็นของแข็งที่อุณหภูมิห้อง มีจุดหลอมเหลวสูง (มากกว่า 400 °C) เนื่องจากพันธะไอออนิกเกิดจากแรงยึดเหนี่ยวของประจุไฟฟ้าซึ่งมีความแข็งแรงสูง ยากต่อการทำให้แยกออกจากกัน อีกทั้งยังมีลักษณะการยึดเหนี่ยวที่ต่อเนื่องกันผลึก การที่จะทำให้สารประกอบไอออนิกเปลี่ยนสถานะจึงต้องอาศัยพลังงานจำนวนมากในการทำลายแรงยึดเหนี่ยว ดังนั้นสารประกอบไอออนิกจึงมีจุดหลอมเหลวและจุดเดือดที่สูงกว่าสารประกอบโคเวเลนต์
-
สารประกอบไอออนิกส่วนใหญ่ละลายได้ดีในน้ำ ได้แก่ เกลือไนเทรต ของโซเดียม โพแทสเซียม และแอมโมเนียม และเกลือคลอไรด์ ส่วนใหญ่ละลายน้ำได้ดี ยกเว้น AgCl, PbCl2, Hg2Cl2
เกลือของซัลเฟต ส่วนใหญ่ละลายน้ำได้ ยกเว้น BaSO4, PbSO4, CaSO4
-
สารละลายของสารประกอบไอออนิกแสดงสมบัติความเป็นกรด-เบส ต่างกัน สารละลายของสารประกอบคลอไรด์มีสมบัติเป็นกลาง และสารละลายของสารประกอบออกไซด์มีสมบัติเป็นเบส
แหล่งที่มา
ณัฐวัฒน์ ธนสารโชคพิบูลย์. สารประกอบไอออนิก. สืบค้นเมื่อวันที่ 15 ธันวาคม 2561 . จาก www.digitalschool.club/digitalschool/chemical2_2_1/chemical2_1/index2_1.php
- De Leon. Formulas for ionic compounds. Retrieved December 12, 2018. from www.iun.edu/~cpanhd/C101webnotes/composition/formioncmpds.html



