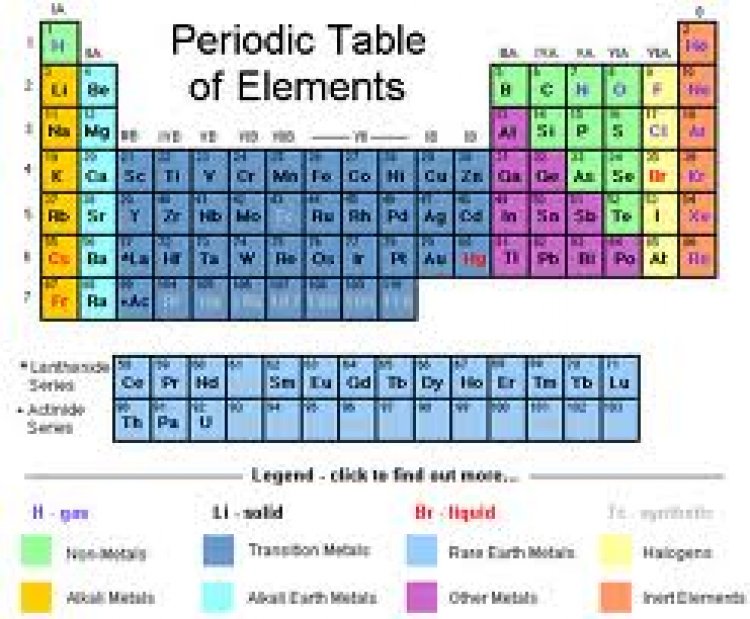
ตารางธาตุ
- 1. การแนะนำ
- 2. บทเรียนที่ 2 รัศมีอะตอม
- 3. บทเรียนที่ 3 พลังงานไอออไนเซชัน
- 4. บทเรียนที่ 4 สารประกอบออกไซด์และคลอไรด์
- 5. บทเรียนที่ 5 สมบัติของธาตุหมู่ IA
- 6. บทเรียนที่ 6 สมบัติของธาตุหมู่ IIA
- 7. บทเรียนที่ 7 สมบัติของธาตุหมู่ VIIA
- 8. บทเรียนที่ 8 ตำแหน่งของธาตุไฮโดรเจน
- 9. บทเรียนที่ 10 ธาตุกัมมันตรังสี(1)
- 10. บทเรียนที่ 9 สมบัติของธาตุแทรนซิชัน
- 11. บทเรียนที่ 11 ธาตุกัมมันตรังสี(2)
- 12. บทเรียนที่ 12 สารประกอบเชิงซ้อนของธาตุแทรนซิชัน(1)
- 13. บทเรียนที่ 13 ทบทวนตารางธาตุ
- - ทุกหน้า -
บทเรียนที่ 2 รัศมีอะตอม
ตารางธาตุ เป็นอีกหนึ่งเครื่องมือของนักเคมีที่ช่วยจัดระเบียบของธาตุต่าง ๆ ที่ค้นพบ ทำให้เราจำสมบัติของธาตุได้ง่ายเนื่องจากสมบัติเหล่านั้นของธาตุในตารางธาตุมีแนวโน้มอย่างชัดเจน ดังนั้นถ้าเราทราบสมบัติของธาตุหนึ่ง เราก็สามารถทำนายสมบัติของธาตุอื่นได้ด้วย เช่น เราทราบว่าขนาดอะตอมของ Li เท่ากับ 152 พิโคเมตร แล้วขนาดอะตอมของ Be เป็นเท่าใด เราสามารถตอบอย่างคร่าว ๆ ว่า "ควรจะมีขนาดอะตอมน้อยกว่า 152 พิโคเมตร" เป็นต้น
|
ขนาดอะตอม (atomic size) |
|
ความหมาย
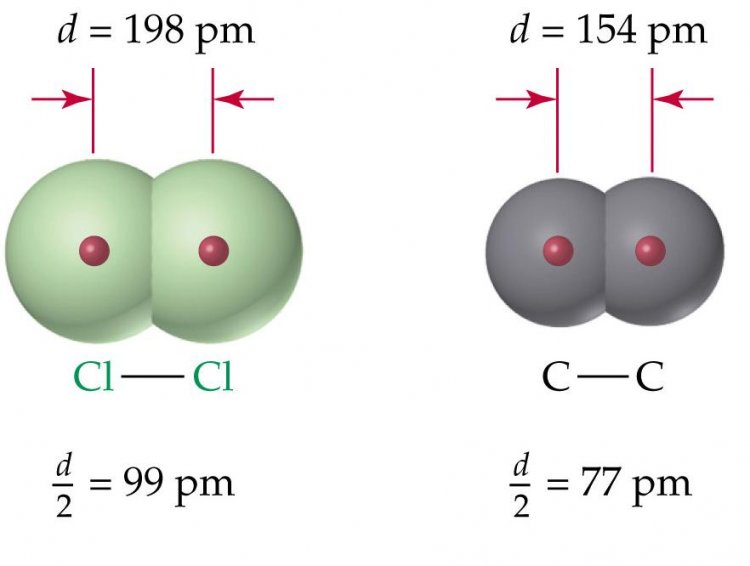
จากรูป ระยะห่างระหว่างอะตอมของคลอรีนเท่ากับ 99 พิโคเมตร ส่วนคาร์บอนเท่ากับ 77 พิโคเมตร |
กลับไปที่เนื้อหา
บทเรียนที่ 3 พลังงานไอออไนเซชัน
พลังงานไอออไนเซชัน (ionization energy) ความหมาย พลังงานไอออไนเซชัน คือ พลังงานที่ใช้ในการดึงอิเล็กตรอน 1 อนุภาค ออกจากอะตอมในสถานะแก๊ส กลายเป็นไอออนบวก
Li(g) Li+(g) + e-
- ธาตุที่มีอิเล็กตรอน 1 ตัว คือ ธาตุไฮโดรเจน(H)
H(g) H+(g) + e- IE=1,318 kJ/mol
ธาตุไฮโดรเจนมีพลังงานไอออไนเซชันเท่ากับ 1,318 กิโลจูลต่อโมล แสดงว่าเราต้องให้พลังงานแก่ธาตุไฮโดรเจน 1,318
กิโลจูลต่อโมล จึงจะทำให้อิเล็กตรอนหลุดออกมา
- ธาตุที่มีอิเล็กตรอนมากกว่า 1 ตัว เช่น ธาตุลิเทียม(Li)
Li(g) Li+(g) + e- IE1 = 520 kJ/mol
Li+(g) Li2+(g) + e- IE2 = 7,394 kJ/mol
Li2+(g) Li3+(g) + e- IE3 = 11,815 kJ/mol
จากการสังเกตจากค่าพลังงานไอออไนเซชันจะพบว่า IE1 คือพลังงานที่ให้แก่อะตอมเพื่อดึงอิเล็กตรอนที่อยู่วงนอกสุด(เวเลนซ์อิเล็กตรอน) มีค่าน้อยที่สุด เพราะอิเล็กตรอนที่อยู่ห่างจากนิวเคลียสหลุดออกได้ง่าย ไม่ต้องใช้พลังงานมากเพราะได้รับแรงดึงดูดจากนิวเคลียสน้อย แต่อิเล็กตรอนที่อยู่ใกล้นิวเคลียสจะถูกดึงดูดไว้เราต้องใช้พลังงานมาก เพื่อที่จะทำให้อิเล็กตรอนนั้นหลุดออกมา ดังนั้นค่า IE3 จึงมีค่ามากที่สุด
แนวโน้มพลังงานไอออไนเซชันของธาตุต่าง ๆ ในตารางธาตุ
- ธาตุในหมู่เดียวกัน พลังงานไอออไนเซชันลดลงจากบนลงล่าง เพราะระยะห่างระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนลดลง อิเล็กตรอนจึงหลุดจากอะตอมได้ง่าย เช่น ธาตุในหมู่ IA
พลังงานไอออไนเซชัน Li > Na > K > Rb > Cs > Fr
- ธาตุในคาบเดียวกัน พลังงานไอออไนเซชันเพิ่มขึ้นจากซ้ายไปขวา เพราะค่าประจุนิวเคลียสสุทธิมากขึ้น อะตอมขนาดเล็ก จึงมีแรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนมากขึ้น ทำให้อิเล็กตรอนหลุดยาก จึงต้องใช้พลังงานสูงในการดึงอิเล็กตรอนออกจากอะตอม เช่น ธาตุในคาบที่ 2 พลังงานไอออไนเซชัน Li < Be < B < C < N < O < F
กลับไปที่เนื้อหา
บทเรียนที่ 4 สารประกอบออกไซด์และคลอไรด์
ตาราง แสดงสมบัติของสารประกอบคลอไรด์ของธาตุคาบที่ 2 และคาบที่ 3
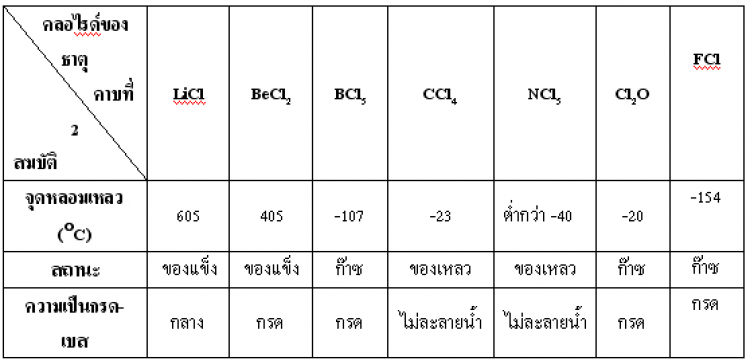
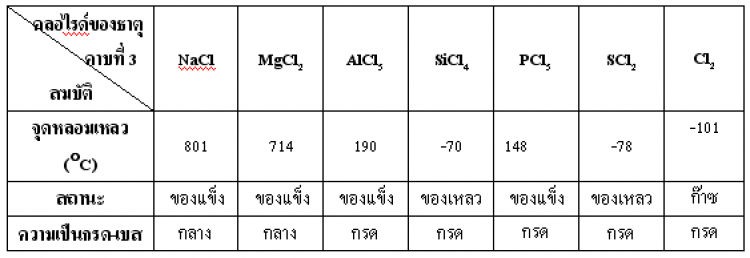
ตาราง แสดงสมบัติของสารประกอบออกไซด์ของธาตุคาบที่ 2 และคาบที่ 3
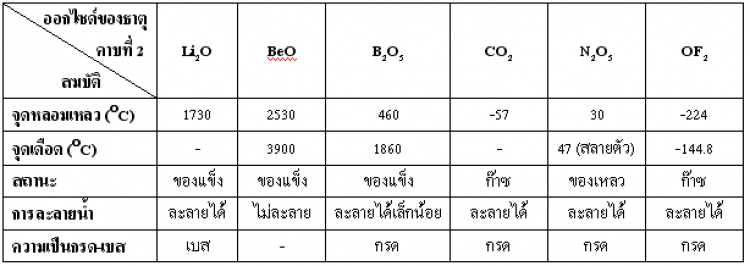
กลับไปที่เนื้อหา
บทเรียนที่ 5 สมบัติของธาตุหมู่ IA
หมู่ที่ 1 ธาตุหมู่ IA ชื่อหมู่โลหะแอลคาไล (alkali metal) ลิเทียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม
สมบัติของโลหะอัลคาไลน์
เป็นโลหะอ่อนสีเงิน ใช้มีดตัดได้
ทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
มีเวเลนซ์อิเล็กตรอน = 1
ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไล ละลายน้ำได้สารละลาย
เบสแก่
Na + O2 ----> Na2O + H2O -----> NaOH + H2
ทําปฏิกิริยากับ H2O รวดเร็วและรุนแรงได้สารละลายเบสกับก๊าซ H2
Na + H2O ------------------> NaOH + H2
เมื่อเป็นไอออน จะมีประจุบวก เช่น Na+ , K+ เป็นต้น
ขนาดอะตอมใหญ่ที่สุดเมื่อเปรียบเทียบกับธาตุในคาบเดียวกัน
E° น้อยเป็นตัว Reduce ที่ดี
เมื่อเป็นไอออน จะมีประจุบวก
โลหะอัลคาไลทำปฏิกิริยากับอโลหะบางชนิดได้ผลึกเกลือสีขาว
ละลายน้ำได้
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- เมื่อเผาสารประกอบหมู่ 1A จะให้เปลวไฟสีต่าง ๆ
Li ได้เปลวไฟสีแดง
Na ได้เปลวไฟสีเหลือง
K ได้เปลวไฟสีม่วง
กลับไปที่เนื้อหา
บทเรียนที่ 6 สมบัติของธาตุหมู่ IIA
สมบัติทั่วไปของธาตุหมู่ IIA
1. ธาตุหมู่ IIA มีความว่องไวต่อปฏิกิริยาและความเป็นโลหะน้อยกว่าธาตุหมู่ IA
2. มีเวเลนซ์อิเล็กตรอนเท่ากับ 2 เป็นโลหะเนื้อแข็งกว่าธาตุหมู่ IA สร้างพันธะโลหะได้แข็งกว่าธาตุหมู่ IA มีความหนาแน่นมากกว่าหมู่ IA เนื่องจากมีขนาดอะตอมเล็กกว่า
3. สารประกอบของธาตุหมู่ IIA เป็นสารประกอบไอออนิก ยกเว้น Be ที่สร้างพันธะโคเวเลนต์
4. มีจุดหลอมเหลวและจุดเดือดสูงกว่าธาตุหมู่ IA เนื่องจากมีขนาดอะตอมเล็กกว่าหมู่ IA และมีพันธะโลหะแข็งแรงกว่า
5. มีค่า IE1 ค่า EN และค่า EA สูงกว่าธาตุหมู่ IA เนื่องจากขนาดอะตอมเล็กกว่าจึงเกิดปฏิกิริยายากกว่า
6 .ไม่พบธาตุหมู่ IIA ที่เป็นอิสระในธรรมชาติ พบในรูปของสารประกอบ
ปฏิกิริยาของธาตุหมู่ IIA
1.ทำปฏิกิริยากับ H2O เกิดเป็นเบสและ H2 แต่ปฏิกิริยาไม่รุนแรง เช่น Mg + H2O -----> Mg(OH)2 + H2
2. ออกไซด์ของโลหะทำปฏิกิริยากับ H2O ได้สารละลายมีสมบัติเป็นเบส
กลับไปที่เนื้อหา
บทเรียนที่ 7 สมบัติของธาตุหมู่ VIIA
ธาตุหมู่ VIIA
ธาตุหมู่ VIIA มีทั้งหมด 5 ธาตุ คือ ฟลูออรีน คลอรีน โบรมีนและแอสทาทีน สำหรับธาตุแอสทาทีนไม่มีในธรรมชาติ เป็นธาตุกัมมันตรังสีที่สังเคราะห์ ธาตุหมู่ VIIA มีชื่อว่า ธาตุแฮโลเจน เพราะสารประกอบของหมู่ VIIA จะเกิดเป็นเกลือที่มีรสเค็ม
ตาราง แสดงสมบัติบางประการของธาตุหมู่ VIIA
|
สมบัติ \ ธาตุ |
F |
Cl |
Br |
I |
|
เลขอะตอม |
9 |
17 |
35 |
53 |
|
การจัดเรียงอิเล็กตรอน |
2,7 |
2, 8, 7 |
2, 8, 8, 7 |
2,8,18,8,7 |
|
รัศมีอะตอม (pm) * |
71 |
99 |
144 |
133 |
|
IE1 (kJ/mol) |
1687 |
1257 |
1146 |
1015 |
|
อิเล็กโทรเนกาติวิตี |
4.0 |
3.0 |
2.8 |
2.5 |
|
อิเล็กตรอนอัฟฟินิตี(kJ/mol) |
333 |
348 |
340 |
297 |
|
จุดหลอมเหลว (oC) |
-220 |
-101 |
-7 |
114 |
|
จุดเดือด(oC) |
-188 |
-34.5 |
59 |
184 |
|
ความหนาแน่น(g/cm3) ** |
1.51 |
1.56 |
3.12 |
4.93 |
|
สถานะปกติ |
ก๊าซ |
ก๊าซ |
ของเหลว |
ของแข็ง |
หมายถึงรัศมีโคเวเลนต์
** ความหนาแน่นของ F2 , Cl2 ในสถานะของเหลว ถ้าเป็นก๊าซจะเท่ากับ 0.00170 และ 0.00312 g/cm3 ตามลำดับ
สรุปสมบัติทั่วๆ ไปของธาตุหมู่ VIIA ได้ดังนี้
1. เป็นอโลหะ มีเวเลนซ์อิเล็กตรอนเท่ากับ 7 สภาวะปกติ F2 และ Cl2 เป็นก๊าซ สีเหลืองอ่อนและเขียวอ่อนตามลำดับ Br2 เป็นของเหลวสีน้ำตาลแดง และ I2 เป็น ของแข็งสีม่วง ซึ่งสีของธาตุฮาโลเจนจะเข้มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น ทุกตัวเป็นสารพิษ
2. ความเป็นโลหะจะเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
3. ธาตุฮาโลเจนทุกตัวอยู่ในสภาพโมเลกุลอะตอมคู่ (diatomic molecule) ทุกสถานะทั้งของแข็ง ของเหลวและก๊าซ โดยยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์
4. ไม่นำความร้อนและไฟฟ้าเพราะเป็นอโลหะ
5. อะตอมมีขนาดเล็ก เมื่อเปรียบเทียบกับธาตุในคาบเดียวกัน แต่มีขนาดใหญ่ขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
6. ความหนาแน่นน้อย แต่ความหนาแน่นจะเพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
7. มีจุดหลอมเหลว จุดเดือดและความร้อนแฝงของการเกิดไอต่ำ เนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุล (คือแรงวันเดอร์วาลส์) น้อย แต่จุดหลอมเหลว จุดเดือดและความร้อนแฝงของการเกิดไอเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น เพราะมีแรงวันเดอร์วาลส์เพิ่มขึ้น นอกจากนี้การระเหยของธาตุหมู่ VIIA จะค่อยๆ ลดลง เมื่อเลขอะตอมเพิ่มขึ้น เพราะแรงวันเดอร์วาลส์เพิ่มขึ้น
8. มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุด ในคาบเดียวกัน และค่าอิเล็กโทรเนกาติวิตีจะค่อยๆ ลดลงเมื่อเลขอะตอมเพิ่มขึ้น
9. มี IE1 ค่อนข้างสูง และค่า IE1 จะค่อยๆ ลดลงเมื่อเลขอะตอมเพิ่มขึ้น เนื่องจากขนาดอะตอมใหญ่ขึ้น
10. มีเลขออกซิเดชันได้หลายค่า เนื่องจากมี 7 เวเลนซ์อิเล็กตรอน ซึ่งสามารถจะให้หรือรับอิเล็กตรอนจากธาตุอื่น หรือใช้อิเล็กตรอนร่วมกับธาตุอื่นๆ ซึ่งมีค่าอิเล็กโทรเนกาติวิตีต่างๆ กันได้ ทำให้มีเลขออกซิเดชันหลายค่า เช่น
ตัวอย่างของธาตุ
Cl มีเลขออกซิเดชันตั้วแต่ -1 ถึง +7
11. เกิดสารประกอบได้หลายชนิด เช่น NaCl CaF2 HF KI และยังเกิดสารประกอบ ที่มีธาตุองค์ประกอบชนิดเดียวกัน
ได้หลายชนิด เพราะมีเลขออกซิเดชันหลายค่า เช่น NaClO NaClO2 NaClO3 NaClO4 Cl2O ClO2 ClO3 และ Cl2O7 เป็นต้น
12. ธาตุหมู่ VIIA ละลายในน้ำได้เล็กน้อยและให้สีต่างๆ กัน เนื่องจากเป็นโมเลกุลไม่มีขั้ว จึงละลายได้ดีในตัวทำละลายอินทรีย์ เช่น ใน CCl4 >> Cl2 ใน CCl4 ไม่มีสี >>Br2 ใน CCl4 สีส้ม >> I2 ใน CCl4 สีม่วง
13. ธาตุที่อยู่ตอนบนของหมู่ สามารถทำปฏิกิริยากับสารประกอบแฮไลด์ของธาตุที่อยู่ตอนล่างได้ แต่ธาตุอยู่ตอนล่าง จะไม่ทำปฏิกิริยากับสารประกอบแฮไลด์ของธาตุที่อยู่ตอนบน จึงสรุปได้ว่า “ความสามารถในการทำปฏิกิริยาของธาตุหมู่ VIIA จะลดลงจากบนลงล่าง” ดังตาราง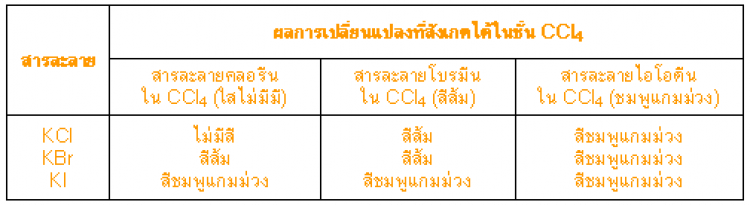
จากข้อมูลในตาราง เมื่อเติมสารละลายคลอรีนใน CCl4 (ใสไม่มีสี) ลงในสารละลาย KBr สารละลายผสมจะแยกเป็น 2 ชั้นและในชั้นของ CCl4 ปรากฏเป็นสีส้ม แสดงว่ามี Br2 เกิดขึ้นและละลายอยู่ในชั้นของ CCl4 เขียนเป็นสมการได้ดังนี้
2Br- + Cl2 2Cl- + I2
ส่วนการเปลี่ยนแปลงที่เกิดขึ้น เมื่อเติมสารละลายคลอรีนและโบรมีนใน CCl4 ลงในสารละลาย KI พบว่าในชั้นของ CCl4 มีสีชมพูแกมม่วง แสดงว่ามี I2 เกิดขึ้นและละลายอยู่ในชั้นของ CCl4 เขียนสมการแสดงปฏิกิริยาได้ดังนี้
2I- + Cl2 2Cl- + I2
2I- + Br2 2Br- + I2
แสดงว่าคลอรีนสามารถทำปฏิกิริยาได้กับทั้ง KBr และ KI โบรมีนทำปฏิกิริยาได้เฉพาะ KI ส่วนไอโอดีนไม่ทำปฏิกิริยากับทั้ง KCl KBr และ KI จากข้อมูลแสดงผลการทดลองในตาราง ช่วยให้สรุปได้ว่า คลอรีนมีความสามารถในการทำปฏิกิริยาได้ดีกว่าโบรมีนและโบรมีนทำปฏิกิริยาได้ดีกว่าไอโอดีน หรืออาจกล่าวได้ว่าความสามารถในการทำปฏิกิริยาของธาตุหมู่ VIIA ลดลงจากบนลงล่าง
กลับไปที่เนื้อหา
บทเรียนที่ 8 ตำแหน่งของธาตุไฮโดรเจน
ตำแหน่งของธาตุไฮโดรเจนในตารางธาตุ
การจัดธาตุให้อยู่ในหมู่ใดของตารางธาตุจะใช้สมบัติที่คล้ายกันเป็นเกณฑ์ ในตารางธาตุปัจจุบันได้จัดให้ธาตุไฮโดรเจน
อยู่ในคาบที่ 1 ระหว่างหมู่ IA กับหมู่ VII A เพราะเหตุใดจึงเป็นเช่นนั้น ให้ศึกษาสมบัติบางประการของธาตุไฮโดรเจน
เปรียบเทียบกับสมบัติของธาตุหมู่ IA และหมู่ VIIA จากตาราง
ตารางแสดงสมบัติบางประการของธาตุไฮโดรเจนกับธาตุหมู่ IA และหมู่ VIIA
สมบัติ ธาตุหมู่ IA ธาตุไฮโดรเจน ธาตุหมู่ VIIA
1. จำนวนเวเลนซ์อิเล็กตรอน 1 1 7
2. เลขออกซิเดชันในสารประกอบ +1 + 1 และ - 1 +1 +3 +5 +7 -1
3. ค่า IE1 (kJ/mol) 382 - 526 1318 1015 - 1687
4. สถานะ ของแข็ง ก๊าซ ก๊าซ / ของเหลว / ของแข็ง
5. การนำไฟฟ้า นำ ไม่นำ ไม่นำ
เมื่อพิจารณาข้อมูลจากตาราง พบว่าธาตุไฮโดรเจนมีสมบัติคล้ายคลึงกับธาตุหมู่ IA และ ธาตุหมู่ VII A จึงไม่จัดธาตุ
ไฮโดรเจนเข้ากับหมู่ IA หรือหมู่ VIIA ได้ คือ
1. มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 เหมือน หมู่ I A แต่ขาดอีก 1 จะจัดเรียงอิเล็กตรอนเหมือนก๊าซเฉื่อย
2. ในสารประกอบทั่วไปมีเลขออกซิเดชันเป็น +1 เหมือนกับหมู่ I A แต่มีเลขออกซิเดชันเป็น –1 ในสารประกอบไฮไดรด์ เช่น LiH ทำให้ไฮโดรเจนมีเลขออกซิเดชันหลายค่าคล้าย หมู่ VIIA
3. ไฮโดรเจนมีสถานะเป็นของแข็งไม่นำไฟฟ้าเหมือนกับ หมู่ VII A
4. ไฮโดรเจนมีค่า IE1 และ EN สูงเหมือนกับธาตุหมู่ VIIA
กลับไปที่เนื้อหา
บทเรียนที่ 10 ธาตุกัมมันตรังสี(1)
Antoine Henri Becquerel (1852-1908) ในปี พ.ศ. 2439 อองตวน อองรี แบกเกอเรล นักฟิสิกส์?ชาวฝรั่งเศส ซึ่งกำลังศึกษาการเรืองแสงของสารต่าง ๆ ได้พบว่าแผ่นฟิลม์ถ่ายรูปซึ่งเก็บไว้ในลิ้นชักที่มีเกลือโพแทสเซียมยูเรนิลซัลเฟต [K2UO2(SO4)2] อยู่ด้วย มีลักษณะเหมือนถูกแสง ทั้ง ๆ ที่ห่อไว้ด้วยกระดาษดำแล้วก็ตาม เขาจึงสรุปว่าสารประกอบของยูเรเนียมจะต้องเปล่งรังสีที่สามารถทะลุผ่านกระดาษดำ และยังสามารถทำให้สารที่รังสีนี้ผ่านเกิดเป็นไอออนได้ จึงเรียกยูเรเนียมและสารอื่น ๆ ที่ให้สมบัติเหมือนยูเรเนียมว่าสารกัมมันตรังสี

หลังจากนั้นไม่นาน ปิแอร์ กูรี (Pierre Curie : 1859 - 1906) และแมรี กูรี (Marie Curie : 186 - 1934) สองสามีภรรยาซึ่งศึกษาเกี่ยวกับธาตุกัมมันตรังสีได้พบว่ากัมมันตภาพรังสีจากสารประกอบไม่ขึ้นกับชนิดของสารประกอบ แต่ขึ้นอยู่กับปริมาณของยูเรเนียมเท่านั้น และได้ค้นพบว่า พอลโลเนียม (Po) เรเดียม (Ra) และทอเรียม (Th) สามารถแผ่รังสีได้
กลับไปที่เนื้อหา
บทเรียนที่ 9 สมบัติของธาตุแทรนซิชัน
ธาตุแทรกซิชัน (transition element) หมายถึง ธาตุหมู่ B ที่อยู่ระหว่างหมู่ธาตุ IIA และ IIIA โดยธาตุแทรนซิชันมีอิเล็กตรอนบรรจุใน d หรือ f-ออร์บิทัลไม่เต็ม ได้แก่ ธาตุ d และกลุ่ม f ในตารางธาตุ ธาตุแทรนซิชันมีการแบ่งเป็นหมู่ได้ 8 หมู่เช่นเดียวกันธาตุ A เริ่มจากหมู่ IIIB, IVB, VB, VIB, VIIB, VIIIB, IB และ IIB ธาตุหมู่ IIB (Zn, Cd, Hg) มีอิเล็กตรอนบรรจุเต็มใน d-ออร์บิทัล
1. ธาตุแทรนซิชันหลัก (main transition) คือ ธาตุแทรนซิชันที่มีการบรรจุอิเล็กตรอนใน d-ออร์บิทัล
2. ธาตุแทรนซิชันชั้นใน (inner transition) คือ ธาตุแทรนซิชันที่มีการบรรจุอิเล็กตรอนที่ f-ออร์บิทัล
สมบัติของธาตุแทรนซิชัน
สมบัติของธาตุแทรนซิชันสรุปได้ดังนี้
1. มีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ยกเว้นธาตุ Cr และ Cu มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 โดยการบรรจุอิเล็กตรอนในสองระดับ พลังงานสุดท้ายควรเป็น 4s23d4 และ 4s23d9 ตามลำดับ แต่ปรากฏว่าเป็น 4s13d5 และ 4s13d10 เพราะการบรรจุอิเล็กตรอนแบบหลังจะทำให้อิเล็กตรอนใน s-ออร์บิทัลเป็นแบบการบรรจุครึ่ง ส่วนใน d-ออร์บิทัลของ Cr เป็นการบรรจุครึ่ง และในd-ออร์บิทัลของ Cu เป็นแบบการบรรจุเต็ม ซึ่งจะทำให้อะตอมมีความเสถียรมากกว่า
2. อิเล็กตรอนในระดับพลังงานหลัก (n) ถัดจากเวเลนซ์อิเล็กตรอนเข้าไป จะมีจำนวนไม่เท่ากัน
3. มีสมบัติเป็นโลหะ เป็นตัวนำไฟฟ้าและความร้อนที่ดี โดย Ag เป็นตัวนำความร้อนและไฟฟ้าที่ดีที่สุด ส่วน Fe, Co, Ni แสดงสมบัติเป็นแม่เหล็กได้ เมื่อวางไว้ในสนามแม่เหล็กเป็นเวลานาน
4.มีขนาดอะตอมใกล้เคียงกันตามคาบ
5.สารประกอบของธาตุแทรนซิชันมีสีเฉพาะตัว
กลับไปที่เนื้อหา
บทเรียนที่ 11 ธาตุกัมมันตรังสี(2)
ในนิวเคลียสของธาตุประกอบด้วยโปรตอน ซึ่งมีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้าสัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสี ออกมากลายไปเป็นอะตอมของธาตุใหม่ที่มีความเสถียรมากขึ้น ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ ดังตัวอย่างต่อไปนี้
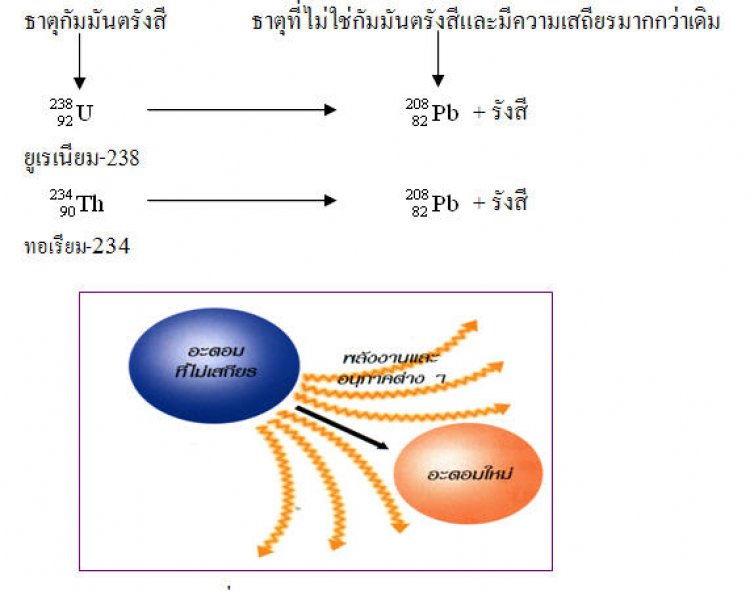
4.2 ธาตุกัมมันตรังสีในธรรมชาติ

4.3 การสลายตัวของธาตุกัมมันตรังสี
ธาตุกัมมันตรังสีสามารถสลายตัวหรือแผ่รังสีได้เองอย่างต่อเนื่องตลอดเวลา อัตราการแผ่รังสี เป็นสมบัติเฉพาะตัวและมีค่าคงที่ สำหรับธาตุกัมมันตรังสีแต่ละชนิด อัตราการแผ่รังสีจะไม่ขึ้นกับปัจจัยภายนอกใด ๆ ทั้งสิ้น เช่น ปริมาณตั้งต้นของสารกัมมันตรังสี อุณหภูมิ และความดัน
ซึ่งแตกต่างจากอัตราการเกิดปฏิกิริยาของสารเคมีทั่วไป แต่จะขึ้นอยู่กับชนิดไอโซโทปโดยทั่วไปรังสีที่ธาตุกัมมันตรังสีปล่อยออกมา ที่ควรทราบมี 3 ชนิด คือ รังสีแอลฟา รังสีบีตาและรังสีแกมมา
กลับไปที่เนื้อหา
บทเรียนที่ 12 สารประกอบเชิงซ้อนของธาตุแทรนซิชัน(1)
Werner's Theory of Coordination Complexes
อัลเฟรด เวอร์เนอร์ (Alfred Werner) ได้พัฒนาแบบจำลองของสารเชิงซ้อน (coordination complexs) ซึ่งอธิบายข้อสังเกตต่อไปนี้
- ข้อแตกต่างอย่างน้อยที่สุด 3 ชนิดของ cobalt (III) complexes สามารถถูกแยกออกมาเมื่อ CoCl2 ละลายในสารละลายแอมโมเนีย แล้วถูกออกซิไดซ์โดยอากาศจนมีเลขออกซิเดชันเป็น +3 สารเชิงซ้อนที่ลำดับที่ 4 สามารถทำได้โดยมีเทคนิคที่แตกต่างเล็กน้อย สารเชิงซ้อนเหล่านี้มีสีแตกต่างกัน และมีสูตรเอมพิริคัลแตกต่างกันด้วย
| CoCl3 · 6 NH3 | ส้ม-เหลือง | |
| CoCl3 · 5 NH3 ·H2O | แดง | |
| CoCl3 · 5 NH3 | ม่วง | |
| CoCl3 · 4 NH3 | เขียว |
-
ความสามารถในการเกิดปฏิกิริยาของแอมโมเนียในสารเชิงซ้อนก็คือจะถูกรีดิวส์อย่างรุนแรง แอมโมเนียจะเกิดปฏิกิริยาอย่างรวดเร็วกับกรดไฮโดรคลอริก (HCl) แล้วเกิดเป็นแอมโมเนียมคลอไรด์ (NH4Cl) ดังสมการ
NH3(aq) + HCl(aq)------> NH4+(aq) + Cl-(aq)
สารเชิงซ้อนเหล่านี้ไม่เกิดปฏิกิริยากับกรดไฮโดรคลอริก แม้จะมีอุณหภูมิสูงถึง 100oC
| CoCl3 · 6 NH3(aq) + HCl(aq)-----//--> |
- สารละลายของคลอไรด์ไอออน (Cl-) เกิดปฏิกิริยากับซิลเวอร์ไอออน (Ag+) แล้วเกิดตะกอนของ AgCl
Ag+(aq) + Cl-(aq) -------> AgCl(s)
เมื่อเติม Ag+ ส่วนที่เกินเติมลงในสารละลาย CoCl3 · 6 NH3 และ CoCl3 · 5 NH3 · H2O ซึ่งเป็นสารเชิงซ้อน AgCl 3 โมลจะสร้างไอออนเชิงซ้อนในสารละลาย อย่างไรก็ตาม Cl- จำนวน 2 ไอออนเท่านั้นใน CoCl3 · 5 NH3 และ Cl- เพียงหนึ่งไอออนเท่านั้นใน CoCl3 · 4 NH3 ที่สามารถเกิดตะกอนกับ Ag+
- การวัดความสามารถในการนำไฟฟ้าของสารละลายสารเชิงซ้อนที่มีน้ำเป็นตัวทำละลาย แนะนำว่า CoCl3 · 6 NH3 และ CoCl3 · 5 NH3 · H2O แตกตัวในน้ำแล้วให้ไอออนรวม 4 ไอออน CoCl3 · 5 NH3 แตกตัวให้ไอออน 3 ไอออน และ CoCl3 · 4 NH3 แตกตัวให้เพียง 2 ไอออนเท่านั้น
เวอร์เนอร์อธิบายข้อสังเกตข้างต้นโดยแนะนำว่าไอออนของโลหะแทรนซิชัน เช่น Co3+ เวเลนซ์ปฐมภูมิ และเวเลนซ์ทุติยภูมิ (primary valence และ secondary valence)
เวเลนซ์อิเล็กตรอนปฐมภูมิหมายถึงจำนวนไอออนลบที่ต้องการประจุของโลหะไอออน ในไอออนเชิงซ้อนแต่ละไอออนของ cobalt (III) complexes ย้อนกลับไปอธิบายได้ว่า Cl- 3 ไอออนต้องการเวเลนซ์อิเล็กตรอนปฐมภูมิของ Co3+
เวเลนซอิเล็กตรอนทุติยภูมิหมายถึงจำนวนไอออนของโมเลกุลที่เกิดพันธะโคออร์ดิเนตกับไอออนของโลหะ เวอร์เนอร์สันนิษฐานว่าเวเลนซ์อิเล็กตรอนทุติยภูมิของโลหะแทรนซิชันในไอออนเชิงซ้อนของ cobalt (III) คือ 6 ดังนั้นสูตรของสารประกอบจึงสามารถเขียนได้ดังนี้
| [Co(NH3)63+][Cl-]3 | ส้ม-เหลือง | |
| [Co(NH3)5(H2O)3+][Cl-]3 | แดง | |
| [Co(NH3)5Cl2+][Cl-]2 | ม่วง | |
| [Co(NH3)4Cl2+][Cl-] | เขียว |
ไอออนของโคบอลต์ไอออนเชิงซ้อนเกิดพันธะโคออร์ดิเนตกับลิแกนด์ 6 ลิแกนด์ ซึ่งเหมาะสมกับเวเลนซ์ปฐมภูมิ Cl- บางไอออนมีอิสระที่จะแตกตัวเมื่อสารเชิงซ้อนละลายในน้ำ แต่บางไอออนจะล้อมรอบ Co3+ ซึ่งจะไม่แตกตัวและไม่เกิดปฏิกิริยากับ Ag+
สารเชิงซ้อน [Co(NH3)6]Cl3 แตกตัวได้ในน้ำ แล้วได้ไอออนรวม 4 ไอออน และมี Cl- อิสระที่จะเกิดปฏิกิริยากับ Ag+ ดังสมการ
|
H2O |
||
|
[Co(NH3)6]Cl3(s) |
---> |
Co(NH3)63+(aq) + 3 Cl-(aq) |
Cl- จำนวน 1 ไอออนอยู่ล้อมรอบโคบอลต์เป็นสารเชิงซ้อน [Co(NH3)5Cl]Cl2 โดยมี 3 ไอออนที่ในโมเลกุล เมื่อสารเชิงซ้อนละลายในน้ำ และเพียง 2 ไอออนเท่านั้นที่จะเกิดตะกอนกับ Ag+
|
H2O |
||
| [Co(NH3)5Cl][Cl]2(s) | ---> | Co(NH3)5Cl2+(aq) + 2 Cl-(aq) |
อีกประการหนึ่ง Cl- 3 ไอออนมีอิสระที่จะแตกตัวเมื่อ [Co(NH3)5(H2O)]Cl3 ละลายในน้ำ และจะเกิดตะกอนเมื่อเติม Ag+ ลงในสารละลาย
|
H2O |
||
| [Co(NH3)5(H2O)]Cl3(s) | ----> | Co(NH3)5(H2O)3+(aq) + 3 Cl-(aq) |
Cl- 2 ไอออนจะอยู่ล้อมรอบ Co ใน [Co(NH3)4Cl2]Cl มีเพียง 2 ไอออนที่จะสร้างไอออนเชิงซ้อนเมื่อสารนี้ละลายในน้ำ และมีเพียง 1 ไอออนที่มิสระที่จะเกิดปฏิกิริยากับ Ag+
|
H2O |
||
| [Co(NH3)4Cl2][Cl](s) | ------> | Co(NH3)4Cl2+(aq) + Cl-(aq) |
เวอร์เนอร์สรุปว่าไอออนเชิงซ้อนของโลหะแทรนซิชันสามารถหนดรูปร่างตามทฤษฎีที่เขาสร้างขึ้น โดยมีลิแกนด์จำนวน 6 ลิแกนด์สร้างพันธะโคออร์ดิเนต ดังแสดงในภาพต่อไปนี้
กลับไปที่เนื้อหา
บทเรียนที่ 13 ทบทวนตารางธาตุ
ตารางธาตุ (Periodic table of elements)
ตารางธาตุ (Periodic table of elements) คือ ตารางที่นักวิทยาศาสตร์ได้รวบรวมธาตุต่างๆ ไว้เป็นหมวดหมู่ตามลักษณะ และคุณสมบัติที่เหมือนกัน เพื่อเป็นประโยชน์ในการศึกษาในแต่ละส่วนของตารางธาตุ โดยคาบ ( Period ) เป็นการจัดแถวของธาตุแนวราบ ส่วนหมู่ ( Group ) เป็นการจัดแถวของธาตุในแนวดิ่ง ซึ่งมีรายละเอียดดังต่อไปนี้
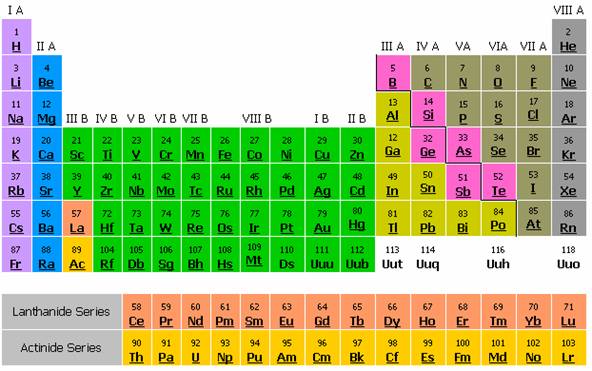
ภาพตารางธาตุปัจจุบัน
- ธาตุหมู่หลัก มีทั้งหมด 8 หมู่ 7 คาบ โดยธาตุที่อยู่ด้านซ้ายของเส้นขั้นบันได จะเป็นโลหะ (Metal) ส่วนทางด้านขวาเป็นอโลหะ (Non metal) ส่วนธาตุที่อยู่ติดกับเส้นขั้นบันไดนั้น จะเป็นกึ่งโลหะ (Metalloid)
- ธาตุทรานซิชัน มีทั้งหมด 8 หมู่ แต่หมู่ 8 มีทั้งหมด 3 หมู่ย่อย จึงมีธาตุต่างๆ รวม 10 หมู่ และมีทั้งหมด 4 คาบ
ธาตุอินเนอร์ทรานซิชัน มี 2คาบโดยมีชื่อเฉพาะเรียกคาบแรกว่าคาบแลนทาไนด์ - (Lanthanide series) และเรียกคาบที่สองว่า คาบแอกทิไนด์ (Actinide series) เพราะเป็นคาบที่อยู่ต่อมาจาก 57La (Lanthanum) และ 89Ac (Actinium) ตามลำดับ คาบละ 14 ตัวรวมเป็น 28 ตัว
การจัดเรียงธาตุลงในตารางธาตุ
เมื่อทราบการจัดเรียงอิเล็กตรอนของธาตุต่างๆ แล้ว จะเห็นว่าสามารถจัดกลุ่มธาตุได้ง่ายขึ้น โดยธาตุที่มีระดับพลังงานเท่ากัน ก็จะถูกจัดอยู่ในคาบเดียวกัน ส่วนธาตุที่มีจำนวนอิเล็กตรอนในระดับพลังงานนอกสุดเท่ากัน ก็จะถูกจัดอยู่ในหมู่เดียวกัน ดังภาพ
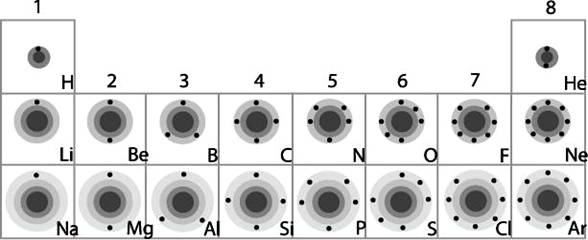
ภาพการจัดเรียงธาตุลงในตารางธาตุ
ประเภทของธาตุในตารางธาตุ
ธาตุโลหะ (metal) โลหะทรานซิชันเป็นต้นฉบับของโลหะ ธาตุโลหะเป็นธาตุที่มีสถานะเป็นของแข็ง ( ยกเว้นปรอท ที่เป็นของเหลว) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง ( ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na) เหล็ก (Fe) แคลเซียม (Ca) ปรอท (Hg) อะลูมิเนียม (Al) แมกนีเซียม (Mg) สังกะสี (Zn) ดีบุก (Sn) เป็นต้น
ธาตุอโลหะ ( Non metal ) มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน( C ) ฟอสฟอรัส (P) กำมะถัน (S) โบรมีน (Br) ออกซิเจน (O 2) คลอรีน (Cl 2) ฟลูออรีน (F 2) เป็นต้น
ธาตุกึ่งโลหะ (metalloid) เป็นธาตุกึ่งตัวนำ คือ มันจะสามารถนำไฟฟ้าได้เฉพาะในภาวะหนึ่งเท่านั้น ธาตุกึ่งโลหะเหล่านี้จะอยู่บริเวณเส้นขั้นบันได ได้แก่ โบรอน (B) ซิลิคอน ( Si) เป็นต้น
ธาตุกัมมันตรังสี เป็นธาตุที่มีส่วนประกอบของ นิวตรอน กับโปรตอน ไม่เหมาะสม (>1.5) ธาตุที่ 83ขึ้นไปเป็นธาตุกัมมันตภาพรังสีทุกไอโซโทปมีครึ่งชีวิต
สมบัติของธาตุในแต่ละหมู่
ธาตุหมู่ I A หรือโลหะอัลคาไล (alkaline metal)
- โลหะอัลคาไล ได้แก่ ลิเทียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม
- เป็นโลหะอ่อน ใช้มีดตัดได้
- เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
- ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
- เมื่อเป็นไอออน จะมีประจุบวก
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- มีเวเลนซ์อิเล็กตรอน = 1
ธาตุหมู่ II A หรือโลหะอัลคาไลน์เอิร์ธ (alkaline earth)
- โลหะอัลคาไลน์เอิร์ธ ได้แก่ เบริลเลียม แมกนีเซียม แคลเซียม สตรอนเชียม แบเรียม เรเดียม
- มีความว่องไวต่อการเกิดปฏิกิริยามาก แต่น้อยกว่าโลหะอัลคาไล
- ทำปฏิกิริยากับน้ำได้สารละลายเบส สารประกอบโลหะอัลคาไลน์เอิร์ธพบมากในธรรมชาติ
- โลหะอัลคาไลน์เอิร์ธมีความว่องไวแต่ยังน้อยกว่าโลหะอัลคาไล
- โลหะอัลคาไลน์เอิร์ธมีเวเลนซ์อิเล็กตรอน = 2
ธาตุหมู่ III
- ธาตุหมู่ III ได้แก่ B Al Ga In Tl
- มีเวเลนซ์อิเล็กตรอน = 3
ธาตุหมู่ IV
- ธาตุหมู่ IV ได้แก่ C Si Ge Sn Pb
- มีเวเลนซ์อิเล็กตรอน = 4
ธาตุหมู่ V
- ธาตุหมู่ V ได้แก่ N P As Sb Bi
- มีเวเลนซ์อิเล็กตรอน = 5
ธาตุหมู่ VI
- ธาตุหมู่ VI ได้แก่ O S Se Te Po
- มีเวเลนซ์อิเล็กตรอน = 6
ธาตุหมู่ VII หรือหมู่แฮโลเจน (Halogen group)
- หมู่ธาตุแฮโลเจน ได้แก่ ฟลูออรีน คลอรีน โบรมีน ไอโอดีน และแอสทาทีน
- เป็นหมู่อโลหะที่ว่องไวต่อการเกิดปฏิกิริยามากที่สุด (F ว่องไวต่อการเกิดปฏิกิริยามากที่สุด)
- เป็นธาตุที่มีพิษทุกธาตุและมีกลิ่นแรง
- โมเลกุลของธาตุแฮโลเจนประกอบด้วย 2 อะตอม (Cl 2 Br 2 I 2)
- แฮโลเจนไอออนมีประจุบลบหนึ่ง (F - C - Br - I - At -)
ธาตุหมู่ VIII หรือก๊าซเฉื่อย หรือก๊าซมีตระกูล (Inert gas )
- ก๊าซมีตระกูล ได้แก่ ฮีเลียม นีออน อาร์กอน คริปทอน ซีนอน และเรดอน
- มีเวเลนซ์อิเล็กตรอนเต็ม 8 อิเล็กตรอน จึงทำให้เป็นก๊าซที่ไม่ว่องไวต่อการเกิดปฏิกิริยา
- ก๊าซมีตระกูลอยู่เป็นอะตอมเดี่ยว แต่ยกเว้น Kr กับ Xe ที่สามารถสร้างพันธะได้
ขนาดอะตอมของธาตุ
หน่วยพิโกเมตร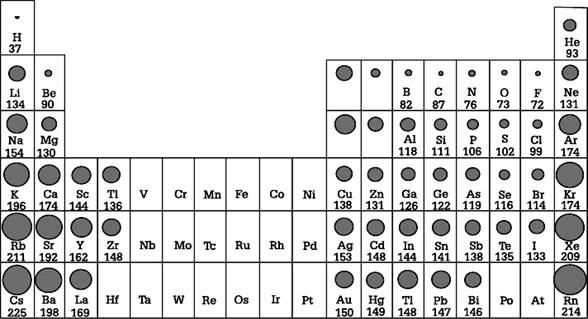
ขนาดอะตอมของธาตุต่างๆ
ขนาดของอะตอมนั้นถ้าจะพิจารณาถึงปัจจัยต่างๆ ที่ส่งผลกระทบต่อขนาดของอะตอมนั้น อาจแบ่งแยกออกได้เป็นข้อ เรียงตามลำดับความสำคัญได้ดังนี้
1. จำนวนระดับพลังงาน
2. จำนวนโปรตอน
3. จำนวนอิเล็กตรอน
ขนาดไอออนของธาตุ
 ............................
............................ 
หน่วยพิโกเมตร
สมบัติอื่นๆ ของธาตุ
พลังงานไอโอไนเซชัน (Ionization Energy : IE) หมายถึง พลังงานปริมาณน้อยที่สุด ที่ทำให้อิเล็กตรอนหลุดจากอะตอม ในสถานะก๊าซ เช่น
ธาตุที่มีอิเล็กตรอนมากกว่า 1 ตัว เช่น ธาตุลิเทียม(Li)
Li(g) ![]() Li +(g) + e - IE 1 = 520 kJ/mol
Li +(g) + e - IE 1 = 520 kJ/mol
Li +(g) ![]() Li 2+(g) + e - IE 2 = 7,394 kJ/mol
Li 2+(g) + e - IE 2 = 7,394 kJ/mol
Li 2+(g) ![]() Li 3+(g) + e - IE 3 = 11,815 kJ/mol
Li 3+(g) + e - IE 3 = 11,815 kJ/mol
จากการสังเกตจากค่าพลังงานไอออไนเซชันจะพบว่า IE 1 คือพลังงานที่ให้แก่อะตอมเพื่อดึงอิเล็กตรอนที่อยู่วงนอกสุดมีค่าน้อยที่สุด เพราะอิเล็กตรอนที่อยู่ห่างจากนิวเคลียสหลุดออกได้ง่าย
อิเล็กโทรเนกาติวิตี (Electronegativity : EN) หมายถึง ความสามารถในการดึงดูดอิเล็กตรอนในพันธะเข้ามาหาตัวเอง
Na + -------> Cl -
จากภาพจะเห็นว่า อะตอมของ Cl มีความสามารถในการดึงดูดอิเล็กตรอนเข้าหาตัวเองได้ดีกว่า Na แสดงว่า Cl มีค่าอิเล็กโทรเนกาติวิตีสูงกว่า Na
สัมพรรคภาพอิเล็กตรอน ( Electron Affinity : EA ) คือ พลังงานที่อะตอมในสถานะก๊าซคายออกมาเมื่อได้รับอิเล็กตรอน สมการเป็นดังนี้
F(g) + e - ![]() Li -(g) + พลังงาน EA = -333 kJ/mol
Li -(g) + พลังงาน EA = -333 kJ/mol


การแบ่งกลุ่มย่อยตามสมบัติของ 20 ธาตุแรก
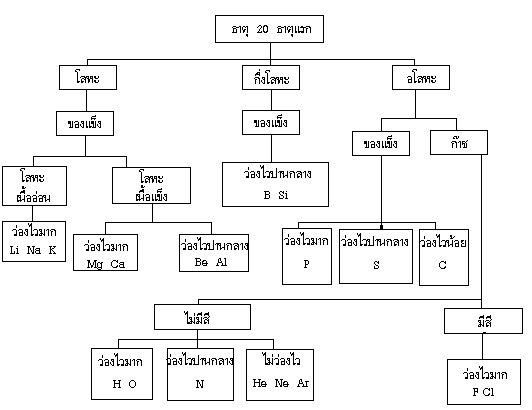
แผนภาพสรุปแนวโน้มสมบัติของธาตุในตารางธาตุ
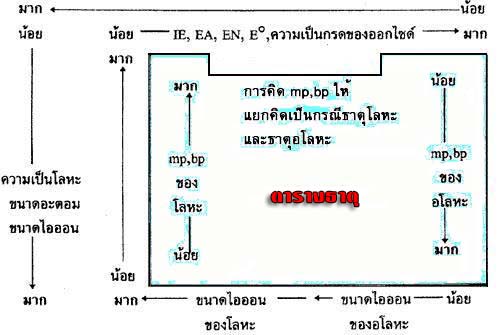
กลับไปที่เนื้อหา