สารและสมบัติของสาร
- 1. การแนะนำ
- 2. บทเรียนที่ 2 สารเนื้อเดียว
- 3. บทเรียนที่ 3 สารเนื้อผสม
- 4. บทเรียนที่ 4 สารแขวนลอย
- 5. บทเรียนที่ 5 สารคอลลอยด์(1)
- 6. บทเรียนที่ 6 คอลลอยด์(2)
- 7. บทเรียนที่ 7 สารละลาย
- 8. บทเรียนที่ 8 การกรอง
- 9. บทเรียนที่ 9 การกลั่น(1)
- 10. บทเรียนที่ 10 การกลั่น(2)
- 11. บทเรียนที่ 11 การสกัดด้วยตัวทำละลาย
- 12. บทเรียนที่ 12 การใช้กรวยแยก
- 13. บทเรียนที่ 13 โครมาโทกราฟี
- 14. บทเรียนที่ 14 การตกผลึก
- 15. บทเรียนที่ 15 การแยกสารด้วยวิธีอื่นๆ
- 16. บทเรียนที่ 16 สารละลายกรด-เบสในชีวิตประจำวัน
- 17. บทเรียนที่ 17 ปฏิกิริยาเคมี
- 18. บทเรียนที่ 18 สถานะของสาร
- 19. บทเรียนที่ 19 พลังงานกับการละลายของสาร
- - ทุกหน้า -

บทเรียนที่ 1 สมบัติของสาร
สมบัติของสาร หมายถึง ลักษณะเฉพาะตัวของสารที่สามารถบ่งบอกว่าสารชนิดนั้นคืออะไร สารแต่ละชนิดจะมีสมบัติของสารที่สังเกตได้ คือ สี กลิ่น รส สถานะ เนื้อสาร ถ้าต้องการตรวจสอบว่าของเหลวใส ไม่มีสี เป็นสารละลายน้ำตาลหรือสารละลายเกลือแกง ต้องทดสอบสมบัติเฉพาะตัวคือ รส หรือทดสอบการนำไฟฟ้า
|
สมบัติ |
เครื่องมือที่ใช้หรือวิธีใช้ในการตรวจสอบ |
|
1. การนำไฟฟ้า 2. การละลาย 3. ความเป็นกรด-เบส ของสาร 4. อุณหภูมิ 5. มวล 6. จุดหลอมเหลว 7. จุดเดือด |
- ชุดเครื่องตรวจการนำไฟฟ้า - นำไปละลายในตัวทำละลาย - ใช้กระดาษลิตมัสทดสอบสารละลาย ถ้าเป็นของแข็งต้องละลายน้ำก่อนทดสอบด้วยกระดาษลิตมัส สารละลายที่มีสมบัติเป็นกรดจะเปลี่ยนสีกระดาษลิตมัสจากสีน้ำเงินเป็นสีแดง สารละลายที่มีสมบัติเป็นเบสจะเปลี่ยนสีกระดาษลิตมัสจากสีแดงเป็นสีน้ำเงิน - เทอร์มอมิเตอร์ - เครื่องชั่ง - ใช้เทอร์มอมิเตอร์วัดอุณหภูมิขณะหลอมเหลว - ใช้เทอร์มอมิเตอร์วัดอุณหภูมิขณะเดือด |
กลับไปที่เนื้อหา
บทเรียนที่ 2 สารเนื้อเดียว
สารเนื้อเดียว (Homogeneous Substance) หมายถึง สารที่มีลักษณะของเนื้อสารผสมกลมกลืนกันเป็นเนื้อเดียว และมีอัตราส่วนของผสมเท่ากัน ถ้านำส่วนใดส่วนหนึ่งของสารเนื้อเดียวไปทดสอบจะมีสมบัติเหมือนกันทุกประการ เช่น น้ำกลั่นและเกลือแกง เป็นสารเนื้อเดียว เมื่อนำเกลือแกงใส่ในน้ำแล้วคนให้ละลายจะได้สารละลายน้ำเกลือ ซึ่งเป็นสารเนื้อเดียวที่มีอัตราส่วนของน้ำและเกลือแกงเหมือนกันทุกส่วน
สารเนื้อเดียวมีได้ทั้ง 3 สถานะ คือ
1.สารเนื้อเดียวสถานะของแข็ง เช่น เหล็ก ทองคำ ทองแดง สังกะสี อะลูมิเนียม นาก ฟิวส์ ทองเหลือง หินปูน เกลือแกง น้ำตาลทราย เป็นต้น
2.สารเนื้อเดียวสถานะของเหลว เช่น น้ำกลั่น น้ำเกลือ น้ำส้มสายชู น้ำอัดลม น้ำมันพืช เอทานอล น้ำเชื่อม น้ำนม เป็นต้น
3.สารเนื้อเดียวสถานะแก๊ส เช่น อากาศ แก๊สหุงต้ม แก๊สออกซิเจน แก๊สไนโตรเจน แก๊สคาร์บอนไดออกไซด์ เป็นต้น
นักวิทยาศาสตร์จำแนกสารเนื้อเดียวออกเป็น 2 ประเภท คือ
1.สารบริสุทธิ์ ( Pure Substance ) เป็นสารเนื้อเดียวที่ประกอบด้วยสารเพียงอย่างเดียว ไม่มีสารอื่นเจือปน ได้แก่ ธาตุและสารประกอบ
2.สารไม่บริสุทธิ์ เป็นสารเนื้อเดียวที่ประกอบด้วยสารบริสุทธิ์ตั้งแต่ 2 ชนิดขึ้นไปด้วยอัตราส่วนที่ไม่แน่นอน ไม่มีปฏิกิริยาเคมีเกิดขึ้น สารที่เกิดใหม่จะมีสมบัติไม่คงที่ขึ้นอยู่กับปริมาณของสารบริสุทธิ์ที่นำมาผสมกัน ได้แก่ สารละลาย คอลลอยด์
กลับไปที่เนื้อหา
บทเรียนที่ 3 สารเนื้อผสม
สารเนื้อผสม ( Heterogeneous Substance) หมายถึง สารที่มีลักษระของเนื้อสารคละกัน ไม่ผสมกลมกลืนเป็นเนื้อเดียวกัน สารที่เป็นส่วนผสมแต่ละชนิดก็ยังคงแสดงสมบัติของสารเดิม เพราะเป็นการรวมกันทางกายภาพไม่มีการเปลี่ยนแปลงทางเคมีเกิดขึ้น เราสามารถใช้ตาเปล่าสังเกตและจำแนกได้ว่าสารเนื้อผสมนั้นประกอบด้วยสารใดบ้าง และสามารถแยกสารเหล่านั้นออกจากกันได้โดยวิธีทางกายภาพธรรมดา ดดยไม่ทำให้สมบัติเดิมเปลี่ยนแปลงไป
สารเนื้อผสมมีได้ทั้ง 3 สถานะ เช่น
1. สารเนื้อผสมสถานะของแข็ง เช่น ทราย คอนกรีต ดิน เป็นต้น
2. สารเนื้อผสมสถานะของเหลว เช่น นำ้คลอง นำ้โคลน นำ้จิ้มไก่ เป็นต้น
3. สารเนื้อผสมสถานะแก๊ส เช่น ฝุ่นละอองในอากาศ เขม่า ควันดำในอากาศ เป็นต้น
กลับไปที่เนื้อหา
บทเรียนที่ 4 สารแขวนลอย
สารแขวนลอย (Suspension) สารแขวนลอยเป็นสารผสมที่อนุภาคของแข็งมีขนาดใหญ่กว่า1x10-4เซนติเมตร แขวนลอยอยู่ในตัวกลางที่เป็นของเหลว มีลักษณะเป็นสารเนื้อผสมที่อนุภาคไม่รวมเป็นเนื้อเดียวกัน สามารถมองเห็นสารผสมได้อย่างชัดเจน อาจแขวลอยอยู่ในของเหลวหรือตกตะกอนเมื่อตั้งทิ้งไว้
อนุภาคของสารแขวนลอยไม่สามารถผ่านกระดาษกรองและกระดาษเซลโลเฟนได้ เช่น ผงถ่านในนำ้ นำ้คลอง นำ้โคลน นำ้ส้มค้น นำ้จิ้มไก่ แป้งมันในนำ้ เป็นต้น
กลับไปที่เนื้อหา
บทเรียนที่ 5 สารคอลลอยด์(1)
คอลลอยด์ (colloid) เป็นสารผสมที่ดูเหมือนจะเป็นเนื้อเดียวกัน โดยแบ่งเป็นส่วนเนื้อเดียว (continous phase) และอนุภาคคอลลอยด์ (dispersed phase) ซึ่งตัวอนุภาคคอนลอยด์จะมีขนาดระหว่าง 10-7-10-4 เซนติเมตร หรือมากกว่าขนาดรูกระดาษเซลโลเฟน แต่น้อยกว่ารูกระดาษกรอง อนุภาคคอนลอยด์จะเกาะตัว ใหญ่กว่าโมเลกุล แต่ไม่ใหญ่มากจะแยกชั้นชัดเจน เช่น นม ควัน เป็นอาทิ
กลับไปที่เนื้อหา
บทเรียนที่ 6 คอลลอยด์(2)
ประเภทของคอลลอยด์
| อนุภาคคอลลอยด์ | ||||
|---|---|---|---|---|
| ก๊าซ | ของเหลว | ของแข็ง | ||
| ส่วนเนื้อเดียว | ก๊าซ | ไม่มี (เพราะก๊าซละลายก๊าซได้) |
ละอองเหลวลอย ตัวอย่าง: หมอก |
ละอองแข็งลอย ตัวอย่าง: ควัน |
| ของเหลว | โฟม ตัวอย่าง: วิปครีม |
อิมัลชัน ตัวอย่าง: มายองเนส |
โซล ตัวอย่าง: นม, สี, น้ำหมึก, เลือด |
|
| ของแข็ง | โฟม ตัวอย่าง: หินพัมมิช |
เจล ตัวอย่าง: เนย, เจลลาติน |
โซล ตัวอย่าง: ruby glass |
|
กลับไปที่เนื้อหา
บทเรียนที่ 7 สารละลาย
สารละลาย (solution) หมายถึง สารเนื้อเดียวที่ไม่บริสุทธิ์ เกิดจากสารตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน สารละลายแบ่งส่วนประกอบได้ 2 ส่วนคือ
1. ตัวทำละลาย (solvent) หมายถึง สารที่มีความสามารถ ในการทำให้สารต่างๆ ละลายได้ โดยไม่ทำปฏิกิริยาเคมีกับสารนั้น
2. ตัวละลาย (solute) หมายถึง สารที่ถูกตัวทำละลายละลายให้กระจายออกไปทั่วในตัวทำละลายโดยไม่ทำปฏิกิริยาเคมีต่อกัน
สารละลายมีทั้ง 3 สถานะ คือ สารละลายของแข็ง สารละลายของเหลว และสารละลายแก๊ส
- สารละลายของแข็ง หมายถึง สารละลายที่มีตัวทำละลายมีสถานะเป็นของแข็ง เช่น ทองเหลือง นาก โลหะบัดกรี สัมฤทธิ์ เป็นต้น
- สารละลายของเหลว หมายถึง สารละลายที่มีตัวทำละลายมีสถานะเป็นของเหลว เช่น น้ำเชื่อม น้ำหวาน น้ำเกลือ น้ำปลา น้ำส้มสายชู น้ำอัดลม เป็นต้น
- สารละลายแก๊ส หมายถึงสารละลายที่มีตัวทำละลายมีสถานะเป็นแก๊ส เช่น อากาศ แก๊สหุงต้ม ลูกเหม็นในอากาศ ไอน้ำในอากาศ เป็นต้น
ตัวละลายแต่ละชนิดจะใช้ตัวทำละลายที่แตกต่างกัน ทั้งนี้ขึ้นอยู่กับความสัมพันธ์ระหว่างตัวทำละลายและตัวถูกละลาย ซึ่งสารทั้ง 2 ชนิดนั้นจะต้องรวมเป็นเนื้อเดียวกันและไม่ทำปฏิกิริยาเคมีต่อกัน ตัวอย่างเช่น
- เกลือ น้ำตาลทราย สีผสมอาหาร จุนสี สารส้ม กรดเกลือ กรดกำมะถัน ใช้น้ำเป็นตัวทำละลาย
- โฟม ยางพารา พลาสติก ใช้น้ำมันเบนซินเป็นตัวทำละลาย
- สีน้ำมัน โฟม พลาสติก แลคเกอร์ ใช้ทินเนอร์เป็นตัวทำละลาย
- สีน้ำมันใช้น้ำมันสนเป็นตัวทำละลาย
การละลายของสารในตัวทำละลาย
เราสามารถทราบได้ว่าสารละลายแต่ละชนิดนั้นมีสารใดเป็นตัวทำละลายและมีสารใดเป็นตัวละลาย โดยมีวิธีการสังเกตตัวทำละลายและตัวละลายดังนี้
1. ใช้สถานะของสารละลายเป็นเกณฑ์ ถ้าสารละลายนั้นเกิดจากสารที่มีสถานะต่างกันละลายเป็นเนื้อเดียวกัน สารใดที่มีสถานะเดียวกันกับสารละลาย สารนั้นจะเป็นตัวทำละลาย เช่น
- น้ำเกลือ ประกอบด้วยน้ำเป็นตัวทำละลายและเกลือเป็นตัวละลาย
- น้ำเชื่อม ประกอบด้วยน้ำเป็นตัวทำละลายและน้ำตาลทรายเป็นตัวละลาย
- น้ำด่างทับทิม ประกอบน้ำเป็นตัวทำละลายและด่างทับทิมเป็นตัวละลาย
- น้ำอัดลม ประกอบด้วยน้ำเป็นตัวทำละลายและแก๊สคาร์บอนไดออกไซด์เป็นตัวละลาย
2. ใช้ปริมาณของสารแต่ละชนิดเป็นเกณฑ์ ถ้าสารละลายนั้นเกิดจากสารที่มีสถานะเดียวกันละลายเป็นเนื้อเดียวกัน สารใดที่มีปริมาณมากกว่า สารนั้นจะเป็นตัวทำละลาย เช่น
- ทองเหลือง ประกอบด้วยทองแดงเป็นตัวทำละลายและสังกะสีเป็นตัวละลาย
- นิโครม ประกอบด้วยนิกเกิลเป็นตัวทำละลายและโครเมียมเป็นตัวละลาย
- นาก ประกอบด้วยทองแดงเป็นตัวทำละลายและทองคำเป็นตัวละลาย
- สัมฤทธิ์ ประกอบด้วยทองแดงเป็นตัวทำละลายและดีบุกเป็นตัวละลาย
กลับไปที่เนื้อหา
บทเรียนที่ 8 การกรอง
คือการทำให้ของแข็งและของเหลวแยกออกจากกันโดยใช้วัสดุต่างๆนอกเหนือจากกระดาษกรองก็ได้ เช่น ผ้าขาวบางหรือผ้าชนิดต่างๆ เป็นต้นส่วนวิธีกรองนั้นก็นำที่มีสิ่งอื่นๆเจือปนมาเทลงที่กระดาษกรองที่พับเป็นรูปกรวยและใส่กรวยแก้วไว้แล้วถ้าของแข็งที่เจือปนอยู่ในของเหลวนั้นมีขนาดใหญ่กว่า10ยกกำลังลบ4ของแข็งนั้นก็ไม่สามารถผ่านกระดาษกรองไปได้แต่ถ้าเล็กกว่าก็จะสามารถผ่านได้ สำหรับกรณีที่ของแข็งเล็กกว่า10ยกกำลังลบ4นั้นเราก็สามารถใช้กระดาษเซลโลเฟนที่มีขนาด10ยกกำลังลบ7ก็ได้
กลับไปที่เนื้อหา
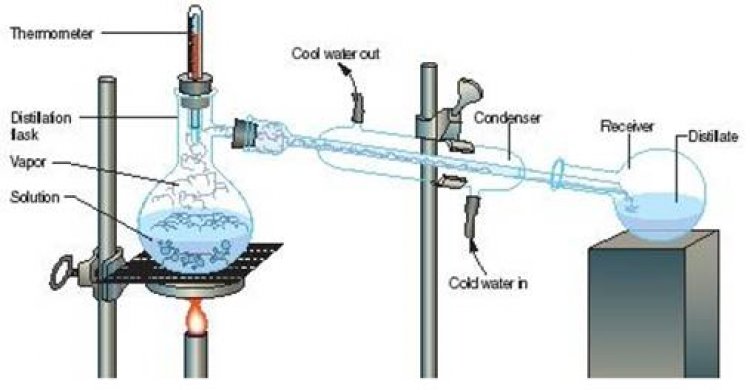
บทเรียนที่ 9 การกลั่น
| การกลั่น (distillation) การกลั่นเป็นการแยกสารละสายที่เป็นของเหลวออกจากของผสม โดยอาศัยหลักการระเหยกลายเป็นไปและควบแน่น โดนที่สารบริสุทธิ์แต่ละชนิดเปลี่ยนสถานะได้ที่อุณหภูมิจำเพาะ สารที่มจุดเดือดต่ำจะเดือดเป็นไอออกมาก่อน เมื่อทำให้ไอของสารมีอุณหภูมิต่ำลงจะควบแน่นกลับมาเป็นของเหลวอีกครั้ง |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
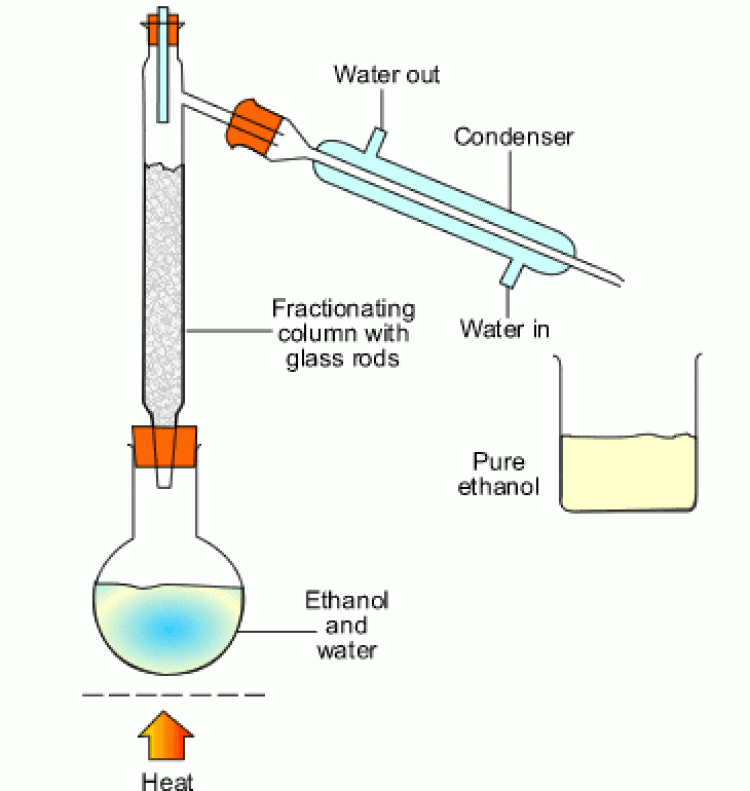
2. การกลั่นลำดับส่วน (fractional distillation) |
||||
| การกลั่นลำดับส่วนเป็นวิธีการแยกของเหลวที่สามารถระเหยได้ตั้งแต่ 2 ชนิดขึ้นไป มีหลักการเช่นเดียวกันกับการกลั่นแบบธรรมดา คือเพื่อต้องการแยกองค์ประกอบในสารละลายให้ออกจากกัน แต่ก็จะมีส่วนที่แตกต่างจากการกลั่นแบบธรรมดา คือ การกลั่นแบบกลั่นลำดับส่วนเหมาะสำหรับใช้กลั่นของเหลวที่เป็นองค์ประกอบของสารละลายที่จุดเดือดต่างกันน้อยๆ ในขั้นตอนของกระบวนการกลั่นลำดับส่วน จะเป็นการนำไอของแต่ละส่วนไปควบแน่น แล้วนำไปกลั่นซ้ำและควบแน่นไอเรื่อย ๆ ซึ่งเทียบได้กับเป็นการการกลั่นแบบธรรมดาหลาย ๆ ครั้งนั่นเอง ความแตกต่างของการกลั่นลำดับส่วนกับการกลั่นแบบธรรมดา จะอยู่ที่คอลัมน์ โดยคอลัมน์ของการกลั่นลำดับส่วนจะมีลักษณะเป็นชั้นซับซ้อน เป็นชั้นๆ ในขณะที่คอลัมน์แบบธรรมดาจะเป็นคอลัมน์ธรรมดา ไม่มีความซับซ้อนของคอลัมน์ | ||||
กลับไปที่เนื้อหา
บทเรียนที่ 10 การกลั่น(2)
|
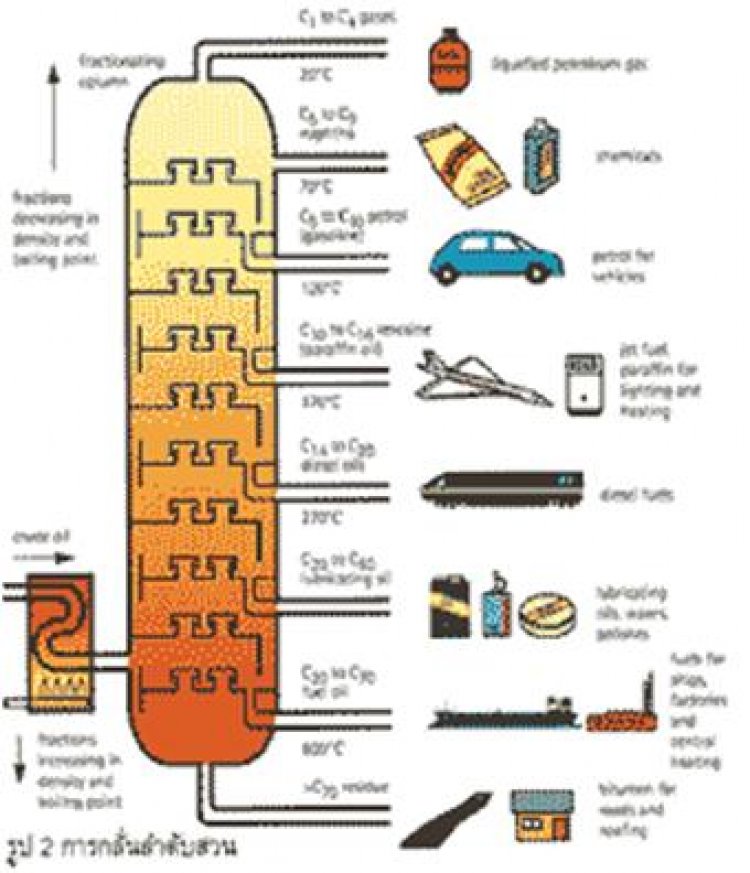
3.การกลั่นน้ำมันดิบ (refining) |
||||
| เนื่องจากน้ำมันดิบประกอบด้วยสารประกอบไฮโดรคาร์บอนหลายพันชนิด ดังนั้นจึงไมสามารถแยกสารที่มีอยู่ออกเป็น สารเดี่ยวๆได้ อีกทั้งสารเหลวนี้มีจุดเดือดใกล้ เคียงกันมากวิธีการแยกองค์ ประกอบน้ำมันดิบจะทําได้โดยการกลั่นลําดับสวนและเก็บสารตามชวงอุณหภูมิ ซึ่งก่อนที่จะกลั่นจะต้องนําน้ำมันดิบมาแยกเอาน้ำและสารประกอบกํามะถันออกซิเจน ไนโตรเจนและโลหะหนักอื่นๆ ออกไปก่อนที่จะนําไปเผาที่อุณหภูมิ 320 - 385 C ผลิตภัณฑ์ที่ได้จากการกลั่น ได้แก่ - ก๊าซ (C1 - C4) ซึ่งเป็ นของผสมระหว่างก๊าซมีเทน อีเทน โพรเพนและบิวเทน เป็นต้นประโยชน์ : มีเทนใช้เป็นเชื้อเพลิงผลิตกระแสไฟฟ้า อีเทน โพรเพนและบิวเทน ใช่ในอุตสาหกรรม - ปิโตรเคมี และโพรเพนและบิวเทนใช่ ทําก๊าซหุงต้ม (LPG) - แนฟทาเบา (C5 - C7) ประโยชน์ : ใช้ทําตัวทําละลาย - แนฟทาหนัก (C6 - C12) หรือ เรียกว่าน้ำ - มันเบนซินประโยชน์ : ใช้ทําเชื้อเพลิงรถยนต์ - น้ำมันก๊าด (C10 - C14) ประโยชน ์ : ใช้ทําเชื้อเพลิงสําหรับตะเกียงและเครื่องยนต์ - น้ำมันดีเซล (C14 - C19) ประโยชน์ : ใช่ ทําเชื้อเพลิงเครื่องยนต์ดีเซล ได้แก่ รถบรรทุก , เรือ - น้ำมันหล่อลื่น (C19 - C35) ประโยชน์: ใช่ทําน้ำมันหล่ อลื่นเครื่องยนตเครื่องจักรกล - ไขน้ำมันเตาและยางมะตอย (C > C35) |
||||
 |
||||
|
4. การสกัดโดยการกลั่นด้วยไอน้ำ |
||||
| เป็นวิธีการสกัดสารออกจากของผสมโดยใช้ไอน้ำเป็นตัวทำละลาย วิธีนี้ใช้สำหรับแยกสารที่ละเหยง่าย ไม่ละลายน้ำ และไม่ทำปฏิกิริยากับน้ำ ออกจากสารที่ระเหยยาก การสกัดโดยการกลั่นด้วยไอน้ำนอกจากใช้สกัดสารระเหยง่ายออกจากสารระเหยยากแล้วยังสามารถใช้แยกสารที่มีจุดเดือดสูงและสลายตัวที่จุดเดือดของมันได้อีก เพราะการกลั่นโดยวิธีนี้ความดันไอเป็นความดันไอของไอน้ำบวกความดันไอของของเหลวที่ต้องการแยก จึงทำให้ความดันไอเท่ากับความดันของบรรยากาศก่อนที่อุณหภูมิจะถึงจุดเดือดของของเหลวที่ต้องการแยก ของ ผสมจึงกลั่นออกมาที่อุณหภูมิต่ำกว่าจุดเดือดของของเหลวที่ต้องการแยก เช่น สาร A มีจุดเดือด 150 C เมื่อสกัดโดยการกลั่นด้วยไอน้ำจะได้สาร A กลายเป็นไอออกมา ณ อุณหภูมิ 95 C ที่ความดัน 760 มิลลิเมตรของปรอท อธิบายได้ว่า ที่ 95 C ถ้าความดันไอของสาร A เท่ากับ 120 มิลลิเมตรของปรอท และไอน้ำเท่ากับ 640 มิลลิเมตรของปรอท เมื่อความดันไอของสาร A รวมกับไอน้ำจะเท่ากับ 760 มิลลิเมตรของปรอท หรือเท่ากับความดันบรรยากาศ จึงทำให้สาร A และน้ำกลายเป็นไอออกมาได้ที่อุณหภูมิต่ำกว่าจุดเดือดของสาร Aตัวอย่างการแยกสารโดยการกลั่นด้วยไอน้ำได้แก่การแยกน้ำมันหอมระเหยออกจากส่วนต่างๆของพืชเช่นการแยกน้ำมันยูคาลิปตัสออกจากใบยูคาลิปตัสการแยกน้ำมันมะกรูดออกจากผิวมะกรูดการแยกน้ำมันอบเชยจากเปลือกต้นอบเชยเป็นต้นในการกลั่นไอน้ำจะไปทำให้น้ำมันหอมระเหยกลายเป็นไอแยกออกมาพร้อมกับไอน้ำเมื่อทำให้ไอของของผสมควบแน่นโดยผ่านเครื่องควบแน่นก็จะได้น้ำและน้ำมันหอมระเหยปนกันแต่แยกชั้นกันอยู่ทำให้สามารถแยกเอาน้ำมันหอมระเหยออกจากน้ำได้ง่าย | ||||
|
|
||||
กลับไปที่เนื้อหา
บทเรียนที่ 11 การสกัดด้วยตัวทำละลาย
การสกัดด้วยตัวทำละลาย เป็นวิธีทำสารให้บริสุทธิ์ หรือเป็นวิธีแยกสารออกจากกันวิธีหนึ่งการสกัดด้วยตัวทำละลาย อาศัยสมบัติของการละลายของสารแต่ละชนิดสารที่ต้องการสกัดต้องละลายอยู่ในตัวทำละลายซอลซ์เลต เป็นเครื่องมือที่ใช้ตัวทำละลายปริมาณน้อย การสกัดจะเป็นลักษณะการใช้ตัวทำละลายหมุนเวียนผ่านสารที่ต้องการสกัดหลาย ๆ ครั้ง ต่อเนื่องกันไปจนกระทั่งสกัดสาร ออกมาได้เพียงพอ
หลักการสกัดสาร
เติมตัวทำละลายที่เหมาะสมลงในการที่เราต้องการสกัดจากนั้นก็เขย่าแรงๆหรือนำไปต้ม เพื่อให้สารที่เราต้องการจะสกัดละลายในตัวทำละลายที่เราเลือกไว้ สารที่เราสกัดได้นั้นยังเป็นสารละลายอยู่ ถ้าเราต้องการทำให้บริสุทธิ์เราควรจะนำสารที่ได้ไปแยกตัวทำละลายออกมาก่อน อาจจะนำไประเหย หรือนำไปกลั่นต่อไป ตัวอย่างเช่น การสกัดน้ำขิงจากขิง การสกัดคลอโรฟีลล์ของใบไม้
กลับไปที่เนื้อหา
บทเรียนที่ 12 การใช้กรวยแยก
การใช้กรวยแยก
ใช้แยกสารเนื้อผสม ที่เป็นของเหลวผสมอยู่กับของเหลวแต่ไม่รวมเป็นเนื้อเดียวกัน โดยของเหลวที่มี ความหนาแน่นน้อยกว่าจะอยู่ข้างบน ของเหลวที่มีความหนาแน่นมากกว่า จะอยู่ข้างล่าง ตัวอย่าง การแยกน้ำมันที่ผสมปนอยู่กับน้ำ ทำได้โดยนำของผสมมาใส่ลงในกรวยแยก น้ำมันมีความหนาแน่นน้อยกว่าน้ำจะลอยอยู่เหนือน้ำ จากนั้นค่อย ๆเปิดก๊อกของกรวยแยกไข แยกน้ำออกมาก่อน และแยกน้ำมันออกมาทีหลัง
กลับไปที่เนื้อหา
บทเรียนที่ 13 โครมาโทกราฟี
โครมาโทรกราฟี
อาศัยสมบัติ 2 ประการคือ
สารต่างชนิดกันมีความสามารถในการละลายในตัวทำละลายได้ต่างกัน
สารต่างชนิดกันมีความสามารถในการถูกดูดซับด้วยตัวดูดซับได้ต่างกัน
โครมาโทกราฟี (chromatography) เป็นการแยกสารผสมที่มีสี หรือสารที่สามารถทำให้เกิดสีได้ วิธีการนี้จะมีเฟส 2 เฟส คือ เฟสอยู่กับที่ (stationary phase) กับ เฟสเคลื่อนที่ (mobile phase) โดยที่สารในเฟสอยู่กับที่จะทำหน้าที่ดูดซับ (adsorb) สารผสมด้วยแรงไฟฟ้าสถิตย์สารที่ใช้ทำเฟสอยู่กับที่จึงมีลักษณะเป็นผงละเอียดมีพื้นที่ผิวมากเช่นอลูมินา(alumina,Al2O3)ซิลิกาเจล(silica gel,SiO2) หรืออาจจะใช้วัสดุที่สามารถดูดซับได้ดี เช่น ชอล์ก กระดาษ ซึ่งสารที่ทำหน้าที่ดูดซับในเฟสอยู่กับที่ เช่น น้ำ ส่วนเฟสเคลื่อนที่จะทำหน้าที่ชะ (elute)เอาสารผสมออกจากเฟสอยู่กับที่ให้เคลื่อนที่ไปด้วยการจะเคลื่อนที่ได้มากหรือน้อยขึ้นอยู่กับแรงดึงดูดระหว่างสารในสารผสมกับตัวดูดซับในเฟสอยู่กับที่ ดังนั้นสารที่ใช้เป็นเฟสเคลื่อนที่จึงได้แก่ พวกตัวทำละลาย เช่น ปิโตรเลียมอีเทอร์ เฮกเซน คลอโรฟอร์ม เบนซีน ฯลฯ การทำโครมาโทกราฟีสามารถทำได้หลายวิธีจะแตกต่างกันที่เฟสอยู่กับที่ว่า อยู่ในลักษณะใด เช่น
- โครมาโทกราฟีแบบคอลัมน์ (column chromatography) ทำได้โดยการบรรจุสารที่เป็นเฟสอยู่กับที่เช่นอลูมินาหรือซิลิกาเจลไว้ในคอลัมน์แล้วเทสารผสมที่เป็นสารละลายของเหลว
ลงสู่คอลัมน์สารผสมจะผ่านคอลัมน์ช้าๆโดยตัวทำละลายซึ่งเป็นเฟสเคลื่อนที่เป็นผู้พาไป สารในเฟสอยู่กับที่จะดูดซับสารในสารผสมไว้ส่วนประกอบใดของสารผสมที่ถูกดูดซับได้ดีจะเคลื่อนที่ช้า
ส่วนที่ถูกดูดซับไม่ดีจะเคลื่อนที่ได้เร็ว ทำให้สารผสมแยกจากกันได้
- โครมาโทกราฟีแบบชั้นบาง (thin layer chromatography) เป็นโครมาโทกราฟีแบบระนาบ(plane chromatography) โดยทำเฟสอยู่กับที่ให้มีลักษณะเป็นครีมข้น แล้วเคลือบบนแผ่นกระจกให้ความหนาของการเคลือบเท่ากันตลอดแล้วนำไปอบให้แห้ง หยดสารละลายของสารผสมที่ต้องการแยกบนแผ่นที่เคลือบเฟสอยู่กับที่นี้ไว้ แล้วนำไปจุ่มในภาชนะที่บรรจุตัวทำละลายที่เป็นเฟสเคลื่อนที่ไว้ โดยให้ระดับของตัวทำละลายต้องอยู่ต่ำกว่าระดับของจุดที่หยดสารผสมไว้ ตัวทำละลายจะซึมไปตามเฟสอยู่กับที่ด้วยการซึมตามรูเล็กเหมือนกับน้ำที่ซึมไปในกระดาษหรือผ้า เมื่อซึมถึงจุดที่หยดสารผสมไว้ ตัวทำละลายจะชะเอาองค์ประกอบในสารผสมนั้นไปด้วยอัตราเร็วที่แตกต่างกัน ทั้งนี้ขึ้นอยู่กับสภาพมีขั้ว (polarity) ของสารที่เป็นองค์ประกอบกับสารที่เป็นตัวทำละลาย ถ้าตัวทำละลายเป็นโมเลกุลมีขั้ว (polar molecules) จะชะเอาสารในสารผสมที่เป็นสารมีขั้วไปด้วยได้เร็ว ส่วนสารที่ไม่มีขั้วในสารผสมจะถูกชะพาไปได้ช้า สารผสมก็จะแยกออกจากกัน
- โครมาโทกราฟีแบบกระดาษ (paper chromatography) เป็นโครมาโทกราฟีแบบระนาบอีกแบบหนึ่ง มีวิธีการและหลักการเหมือนกับโครมาโทกราฟีแบบชั้นบาง แตกต่างกันที่เฟสอยู่กับที่ใช้กระดาษที่สามารถดูดซับได้แทนกระจกที่เคลือบด้วยซิลิกาเจล
- โครมาโทกราฟีแบบแก๊ส (gas chromatography , GC) ใช้สำหรับแยกสารผสมที่เป็นแก๊ส โดยมีเฟสเคลื่อนที่เป็นแก๊สเช่นกันแต่ไม่ทำปฏิกิริยากับสารผสม เช่น ฮีเลียม จะทำหน้าที่เป็นตัวพา (carier) สารผสม ส่วนเฟสอยู่กับที่อาจจะเป็นของแข็งหรือของเหลวที่บรรจุอยู่ในคอลัมน์ เมื่อทั้งตัวพาและสารผสมเคลื่อนที่ผ่านคอลัมน์นี้ เฟสอยู่กับที่ในคอลัมน์จะดึงดูดด้วยแรงดึงดูดไฟฟ้าสถิตย์ตามความเป็นขั้วของสารกับโมเลกุลในสารผสมทำให้องค์ประกอบในสารผสมถูกพาไปด้วยอัตราเร็วที่ต่างกัน สารผสมก็จะแยกออกจากกัน
ปัจจุบันเทคนิคของโครมาโทกราฟีได้ถูกพัฒนาให้สามารถทำงานได้รวดเร็ว และใช้แยกสารตัวอย่างได้ครั้งละหลายสารตัวอย่าง เช่น Gas - Liquid Chromatography (GLC), High Performance Liquid Chromatography (HPLC) เป็นต้น
หลักการของโครมาโทกราฟี
โครมาโทกราฟีอาศัยหลักการละลายของสารในตัวทำละลายและการถูกดูดซับโดยตัวดูดซับโดยสารที่ต้องการนำมาแยกโดยวิธีนี้จะมีสมบัติการละลายในตัวทำละลายได้ไม่เท่ากันและตัวถูกดูดซับโดยตัวดูดวับได้ไม่เท่ากันทำให้สารเคลื่อนที่ได้ไม่เท่ากัน
วิธีการทำโครมาโทกราฟี
นำสารที่ต้องการแยกมาละลายในตัวทำละลายที่เหมาะสมแล้วให้เคลื่อนที่ไปบนตัวดูดซับการเคลื่อนที่ของสารบนตัวดูดซับขึ้นอยู่กับความสามารถในการละลายของสารแต่ละชนิดในตัวทำละลายและความสามารถในการดูดซับที่มีต่อสารนั้นกล่าวคือสารที่ละลายในตัวทำละลายได้ดีและถูกดูดซับน้อยจะถูกเคลื่อนที่ออกมาก่อนส่วนสารที่ละลายได้น้อยและถูกดูดซับได้ดีจะเคลื่อนที่ออกมาทีหลังถ้าใช้ตัวดูดซับมาก ๆจะสามารถแยกสารออกจากกันได้
การเลือกตัวทำละลายและตัวดูดซับ
1.ตัวทำละลายและสารที่ต้องการแยกจะต้องมีการละลายไม่เท่ากัน
2.ควรเลือกตัวดูดซับที่มีการดูดซับสารได้ไม่เท่ากัน
3.ถ้าต้องการแยกสารที่ผสมกันหลายชนิดอาจต้องใช้ตัวทำละลายหลายชนิดหรือใช้ตัวทำละลายผสม
4.ตัวทำละลายที่นิยมใช้ได้แก่เฮกเซนไซโคลเฮกเซนเบนซีนอะซีโตนคลอไรฟอร์มเอธานอล
5.ตัวดูดซับที่นิยมใช้ได้แก่อะลูมินาเจค (Al2O3)ซิลิกาเจล(SiO2)
ค่า Rf
โครมาโทกราฟีแบบกระดาษสามารถนำมาคำนวณหาค่า Rf ได้
ค่า Rf (Rate of flow) เป็นค่าเฉพาะตัวของสาร ขึ้นอยู่กับชนิดของตัวทำละลายและตัวดูดซับ ดังนั้นการบอกค่า Rf ของสารแต่ละชนิดจึงต้องบอกชนิดของตัวทำละลาย และตัวดูดซับเสมอค่า Rf สามารถคำนวณได้จากสูตร
Rf = ระยะทางที่สารเคมีคลื่อนที่ (cm)
ระยะทางที่ตัวทำละลายเคลื่อนที่ (cm)
สารต่างชนิดกันจะมีค่า Rf แตกต่างกัน เพราะฉะนั้นเราจึงสามารถใช้ค่า Rf มาใช้ในการวิเคราะห์ชนิดของสารได้ กล่าวคือ ถ้าสารใดมีความสามารถในการละลายสูงจะมีค่า Rf มาก เนื่องจากตัวทำละลายจะเคลื่อนที่เร็วกว่าสารที่จะแยก ค่า Rf < 1 เสมอ
ถ้าใช้ตัวทำละลายและตัวดูดซับชนิดเดียวกันปรากฏว่ามีค่า Rf เท่ากัน อาจสันนิษฐานได้ว่า สารดังกล่าวเป็นสารชนิดเดียวกัน หรือนำสารตัวอย่างมาทำโครมาโทกราฟีคู่กับสารจริงก็ได้
ข้อดีของโครมาโทกราฟี
1.สามารถแยกสารที่มีปริมาณน้อยได้
2.สามารถแยกได้ทั้งสารที่มีสี และไม่มีสี
3.สามารถใช้ได้ทั้งปริมาณวิเคราะห์ (บอกได้ว่าสารที่แยกออกมา มีปริมาณเท่าใด)
และคุณภาพวิเคราะห์ (บอกได้ว่าสารนั้นเป็นสารชนิดใด)
4.สามารถแยกสารผสมออกจากกันได้
5.สามารถแยกสารออกจากกระดาษกรองหรือตัวดูดซับโดยสกัดด้วยตัวทำละลาย
กลับไปที่เนื้อหา
บทเรียนที่ 14 การตกผลึก
การตกผลึก (Crystallization) คือกระบวนการเกิดผลึกของแข็งจากสารละลาย(solution) จากของเหลว (melt) หรือไอ (vapor)โดยกระบวนการดังกล่าว อาจเกิดขึ้นเองในธรรมชาติหรือเกิดขึ้นจากการทดลองในห้องปฏิบัติการตัวอย่างการเกิดผลึกในธรรมชาติ เช่น ผลึกน้ำแข็ง(ice crystals) หิมะ (snow) เป็นต้น ผลึกของสารอินทรีย์เช่น อินซูลินและน้ำตาล ผลึกของธาตุเช่น แกลเลียม และซิลิกอน ซึ่งสามารถเกิดในธรรมชาติและถูกสังเคราะห์
การตกผลึก เป็นวิธีทำสารให้บริสุทธิ์ หรือเป็นวิธีแยกสารออกจากกัน วิธีหนึ่ง
การตกผลึก ทำโดยเลือกตัวทำละลายที่เหมาะสมไปสกัดสารที่ต้องการแล้วนำมาตกผลึก สารที่มี สภาพละลายได้ต่างกันมาก สามารถตกผลึกแยกออกจากกันได้
การเลือกตัวทำละลายที่เหมาะสมต่อการตกผลึก มีหลักในการเลือกดังนี้
1. ละลายสารที่ต้องการตกผลึกในขณะร้อนได้ดี และละลายได้น้อยหรือไม่ละลายเลยที่อุณหภูมิต่ำ (ขณะเย็น)
2. ไม่ละลายสารปนเปื้อนขณะร้อนหรือละลายได้น้อยขณะร้อน แต่ละลายได้ดีขณะเย็น
3. ควรมีจุดเดือดต่ำ เพื่อสามารถกำจัดออกจากผลึกได้ง่าย
4. ไม่ทำปฏิกิริยากับสารที่ต้องการตกผลึก
5. ควรทำให้สารที่ที่ต้องการทำให้บริสุทธิ์เกิดเป็นผลึกที่มีรูปร่างชัดเจน
6. ไม่เป็นพิษ
7. หาง่าย และราคาถูก
กลับไปที่เนื้อหา
บทเรียนที่ 15 การแยกสารด้วยวิธีอื่นๆ
การใช้แม่เหล็กดูด
การใช้อำนาจแม่เหล็กป็นวิธีที่ใช้แยกองค์ประกอบของสารเนื้อผสมซึ่งองค์ประกอบหนึ่งมีสมบัติในการถูกแม่เหล็กดูดได้ เช่น ของผสมระหว่างผงเหล็กกับผงกำมะถัน โดยใช้แม่เหล็กถูไปมาบนแผ่นกระดาษที่วางทับของผสมทั้งสอง แม่เหล็กจะดูดผงเหล็กแยกออกมา
การตกตะกอน
การตกตะกอน ใช้แยกของผสมเนื้อผสมที่เป็นของแข็งแขวนลอยอยู่ในของเหลว ทำได้โดยนำของผสมนั้นวางทิ้งไว้ให้สารแขวนลอยค่อย ๆ ตกตะกอนนอนก้น ในกรณีที่ตะกอนเบามากถ้าต้องการให้ตกตะกอนเร็วขึ้นอาจทำได้โดย ใช้สารตัวกลางให้อนุภาคของตะกอนมาเกาะ เมื่อมีมวลมากขึ้น น้ำหนักจะมากขึ้นจะตกตะกอนได้เร็วขึ้น เช่น ใช้สารส้มแกว่ง อนุภาคของสารส้มจะทำหน้าที่เป็นตัวกลางให้โมเลกุลของสารที่ต้องการตกตะกอนมาเกาะ ตะกอนจะตกเร็วขึ้น
การใช้มือหยิบออกหรือเขี่ยออก
ใช้แยกของผสมเนื้อผสม ที่ของผสมมีขนาดโตพอที่จะหยิบออกหรือเขี่ยออกได
การแพร่คือการเคลื่อนที่ของโมเลกุลของสารชนิดหนึ่งจากที่หนึ่งไปยังอีกที่หนึ่งทั้งนี้การแพร่เกิดได้หลายรูปแบบแล้วแต่แรงขับเคลื่อนที่มีในขณะนั้น การแพร่ของสารแบบธรรมดา(simplediffusion)คือการเคลื่อนที่ของโมเลกุลสารจากที่ที่ความเข้มข้นมากไปความเข้มข้นน้อยตัวอย่างที่เห็นง่ายๆก็คือเวลาเราหยดหมึกลงในน้ำแล้วโมเลกุลหมึกค่อยๆกระจายไปในโมเลกุลน้ำ
การระเหยแห้ง
การแยกสารด้วยวิธีนี้เหมาะสำหรับใช้แยกสารผสมที่เป็นของเหลวและมีของแข็งละลายในของเหลวนี้ จนทำให้สารผสมมีลักษณะเป็นของเหลวใส ซึ่งเราเรียกสารผสมนี้ว่า สารละลาย เช่น น้ำทะเล น้ำเชื่อมน้ำเกลือ เป็นต้นการแยกสารโดยวิธีการระเหยแห้งนิยมใช้ในการแยกเกลือออกจากน้ำทะเล มีการนำเกลือเพื่อแยกน้ำทะเลให้ได้เกลือสมุทรโดยวิธีการระเหยแห้ง ชาวนาเกลือเตรีมแปงนาแล้วใช้กังหันฉุดน้ำทะเลเข้าสู้แปลงนาเกลือหลังจากนั้นปล่อยให้น้ำทะเลได้รับแสงแดดเป็นเวลานานจนกระทั่งน้ำระเหยจนแห้ง จะเหลือเกลืออยู่ในนา เกลือที่ได้นี้เรียกว่า เกลือสมุทรซึ่งเป็นเกลือที่นำมาปรุงอาหาร ทำเครื่องดื่ม
การเปลี่ยนอุณหภูมิและความดัน
วิธีนี้ใช้สำหรับแยกของผสมที่องค์ประกอบทั้งหมดเป็นก๊าซแต่ละชนิดมีจุดเดือดไม่เท่ากัน
การใช้ความร้อน
วิธีนี้แยกของผสมชนิดก๊าซละลายในของเหลว
กลับไปที่เนื้อหา
บทเรียนที่ 16 สารละลายกรด-เบสในชีวิตประจำวัน
สารละลายกรด – เบสในชีวิตประจำวันมีอยู่มากมาย ซึ่งสามารถจำแนกได้ดังนี้
1. สารประเภททำความสะอาด
- บางชนิดก็มีสมบัติเป็นเบส เช่น สบู่ ผงซักฟอก น้ำยาล้างจาน
- บางชนิดมีสมบัติเป็นกรด เช่น น้ำยาล้าง ห้องน้ำ และเครื่องสุขภัณฑ์
2. สารที่ใช้ทางการเกษตร ได้แก่ ปุ๋ย
- บางชนิดก็มีสมบัติเป็นเบส เช่น ยูเรีย
- บางชนิดมีสมบัติเป็นกรด เช่น แอมโมเนียมคลอไรค์
- บางชนิดมีสมบัติเป็นกลาง เช่น โพแทสเซียมไนเตรต
3. สารปรุงแต่งอาหาร
- บางชนิดก็มีสมบัติเป็นเบส เช่น น้ำปูนใส น้ำขี้เถ้า
- บางชนิดมีสมบัติเป็นกรด เช่น น้ำส้มสายชู น้ำมะนาว น้ำมะขาม
- บางชนิดมีสมบัติเป็นกลาง เช่น ผงชูรส เกลือแกง น้ำตาลทราย ฯลฯ
4. ยารักษาโรค
- บางชนิดก็มีสมบัติเป็นเบส เช่น ยาแอสไพริน วิตามินซี
- บางชนิดมีสมบัติเป็นกรด เช่น ยาลดกรด ยาธาตุ
5. เครื่องสำอาง
- บางชนิดมีสมบัติเป็นกลาง เช่น น้ำหอม สเปรย์ฉีดผม ยารักษาสิวฝ้า
สารละลายกรด-เบสในชีวิตประจำวันและในสิ่งมีชีวิต
*ตัวอย่างสารละลายกรดในชีวิตประจำวันและในสิ่งแวดล้อม มีดังต่อไป
- กรด tartaric [C4H6O6] พบในมะขามป้อม ฝรั่ง
- กรดแอซิติก (acetic acid) [CH3COOH]ใช้ในการผลิตน้ำส้มสายชู
- กรดซิตริก (citric acid) [C6H8O7]เป็นกรดที่อยู่ในผลไม้ที่มีรสเปรี้ยว เช่น ส้ม มะนาว
- กรดแอสคอร์บิก (ascorbic acid) [C6H8O6] มีอยู่ในผลไม้ที่มีรสเปรี้ยว วิตามินC
- กรดอะมิโน (amino acid) เป็นกรดที่ใช้สร้างโปรตีน มักพบในเนื้อสัตว์ ผลไม้
- กรดซัลฟิวริก [H2SO4] ทำปุ๋ยเคมี
- กรดboric [H3BO3] ยาฆ่าเชื้อโรค , น้ำยาล้างตา
- กรดไฮโดรคลอริก [HCl] น้ำยาล้างสุขภัณฑ์
- กรดออกซาลิก [H2C2O2] กำจัดรอยเปื้อนสนิม
- กรดคาร์บอนิก [H2CO3] เป็นส่วนประกอบของน้ำอัดลม
*ตัวอย่างสารละลายเบสในชีวิตประจำวันและสิ่งแวดล้อม มีดังต่อไปนี้
1. สารประเภททำความสะอาด
- NaOH ใช้ทำสบู่
- แอมโมเนีย (NH3) น้ำยาล้างกระจก,น้ำยาปรับผ้านุ่ม
- Na2CO3 อุตสาหกรรมผงซักฟอก
2. สารปรุงแต่งอาหาร
-NaOH ทำผงชูรส
-NaHCO3 ทำขนม
3. สารที่ใช้ทางการเกษตร ได้แก่ ปุ๋ย
- ยูเรีย
- Ca(OH)2 แก้ดินเปรี้ยว
4. ยารักษาโรค
-NH3-(NH4)2CO3 แก้เป็นลม
-Ca(OH)2 ลดกรดในกระเพาะอาหาร
-Mg(OH)2 ลดกรดในกระเพาะอาหาร , ยาถ่าย
สารเคมีที่ใช้ในบ้าน
ในแต่ละวันเราต้องใช้สารละลายกรด – เบส หลายชนิด บางชนิดอยู่ในอาหารที่เรารับประทาน เราใช้สารละลายกรด – เบส ในการทำความสะอาด เครื่องใช้ ของใช้
พื้นห้องน้ำ สุขภัณฑ์ สารที่ทำความสะอาดร่างกายบางชนิดมีสมบัติเป็นเบส
สารละลายหลายชนิดในร่างกายของเราก็มีคุณสมบัติเป็นกรด - เบส เช่น
น้ำย่อยในกระเพาะอาหารของคนเรามี pH อยู่ใน ช่วง 1.6 - 2.5 ซึ่งมีคุณสมบัติเป็นกรด เพื่อทำหน้าที่ย่อยโปรตีน
ในแต่ละวันเราต้องใช้สารทำความสะอาดเพื่อกำจัดฝุ่นละออง เหงื่อไคล และสิ่งสกปรกออกจากผิวหนังๆแต่ละส่วนของร่างกายจึงใช้ สารทำความสะอาดแตกต่างกัน เช่น ใช้แชมพูทำความสะอาดเส้นผม ใช้สบู่ทำความสะอาดผิวหนัง
บางคนใช้สารทำความสะอาดที่กับใบหน้าโดยเฉพาะ นอกจากประสิทธิในกำจัดสิ่งสกปรกแล้ว สมบัติอื่นๆ ของสารทำความสะอาดที่ใช้กับร่างกาย เช่น กลิ่น สี รวมทั้งความเป็น กรด - เบส ก็เป็นปัจจัยหนึ่งที่เราต้องคำนึงถึงด้วยเมื่อจะเลือกซื้อสารทำความสะอาดกับร่างกาย
ในสมัยก่อน สารทำความสะอาดที่ผสมอยู่ในแชมพูส่วนใหญ่เป็นสารประเภทเดียวกับสบู่ เมื่อสระผมด้วยน้ำกระด้างจึงเกิดไคลสบู่จับอยู่ตามเส้นผม คนในสมัยก่อนจึงนิยมชโลมผมด้วยน้ำมะกรูดหรือน้ำมะนาวเพื่อกำจัดไคลสบู่ออกจากเส้นผมนั่นเอง
ปัจจุบันนี้ใช้สารสังเคราะห์ซึ้งมีสมบัติเป็นสารลดแรงตึงผิวที่สามารถกำจัดสิ่งสกปรกออกจากเส้นผมได้ดีกว่าสบู่มาก นอกจากนี้ยังอาจเติมสารปรับ pH กลิ่น สี ให้น่าใช้และเติมสารที่ทำให้เนื้อแชมพูข้น บางคนนิยมใช้ครีมนวดผมหลังจากที่สระผมแล้ว เพื่อปรับสภาพเส้นผม
การใช้สารรอบตัวโดยเฉพาะสารที่มีสมบัติกัดกร่อน เช่น กรด - เบส นอกจากจะคำนึงถึงสมบัติของสารที่สอดคล้องกับวัตถุประสงค์ของการใช้แล้ว ยังจะต้องคำนึงถึงผลของการใช้สารที่อาจมีต่อสิ่งมีชีวิตอื่นและสิ่งแวดล้อมด้วย จึงควรศึกษาสมบัติของสาร วิธีใช้ และวิธีป้องกันอันตรายอย่างถูกต้อง
เราอาจจะสรุป pH ของสารละลายในชีวิตประจำวันได้ดังนี้
1. ของเหลวบางชนิดอาจจะมีช่วง pH กว้าง และบางชนิดมีช่วง pH แคบตามข้อมูลในตาราง
2. ถ้ารับประทานอาหารประเภทผัก ปัสสาวะจะมี pH สูง แต่ถ้ารับประทานเนื้อสัตว์มาก ปัสสาวะจะมี pH ต่ำ
3. ในร่างกายของคนเราของเหลวบางชนิดมี pH แปรไปได้ในช่วงค่อนข้างกว้าง โดยที่ร่างกายยังคงอยู่ในสภาพปกติไม่เจ็บป่วย แต่ของเหลวบางชนิดในคนปกติมี pH ค่อนข้างคงที่ เช่น เลือดมีค่า pH แปรไปได้เพียง 0.10 เท่านั้น สำหรับคนที่เป็นโรคเบาหวานรุนแรง ค่า pH ของเลือดอาจลดต่ำลงกว่า 7.35 ทำให้เกิดอาการคลื่นไส้ ถ้าลดลงต่ำมากๆ อาจหมดสติถึงตายได้
อย่างไรก็ตาม ปกติในร่างกายของคนจะมีระบบที่ควบคุมค่า pH ของเลือดไว้ให้คงที่
4. ในน้ำฝนซึ่งน่าจะมีสมบัติเป็นกลาง แต่พบว่ามี pH ประมาณ 5.6-6.0 เท่านั้น และปัจจุบันในประเทศอุตสาหกรรม pH ของน้ำฝนมีค่าต่ำถึง 2.8 จากการตรวจสอบพบว่านอกจากมี CO 2 ละลายอยู่แล้วยังมี H 2SO 4 และ HNO 3 ละลายปนอยู่ด้วย
กลับไปที่เนื้อหา
|
กลับไปที่เนื้อหา
บทเรียนที่ 18 สถานะของสาร

|
3. แก๊ส มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยมาก โมเลกุลเคลื่อนที่ได้อย่างอิสระ ทำให้เกิดการฟุ้งกระจายได้เช่น อากาศแก๊สหุงต้ม เป็นต้น
กลับไปที่เนื้อหา
บทเรียนที่ 19 พลังงานกับการละลายของสาร
การละลาย
สารละลายจะประกอบด้วยองค์ประกอบ 2 อย่าง คือตัวทำละลายและตัวถูกละลาย เช่นน้ำเกลือ มีน้ำเป็นตัวทำละลายเกลือเป็นตัวถูกละลายการละลายของสารที่เป็นของแข็งจะมีพลังงานเข้ามาเกี่ยวข้อง 2 ขั้นตอนเสมอ ดังนี้
1. อนุภาคของของแข็งแยกเป็นอนุภาคเล็ก ต้องดูดพลังงานเข้าไปเพื่อแยกของแข็งออกจากกัน พลังงานที่ดูดเข้าไปเรียก พลังงานโครงร่างผลึก เช่นการละลายของโซเดียมคลอไรด์
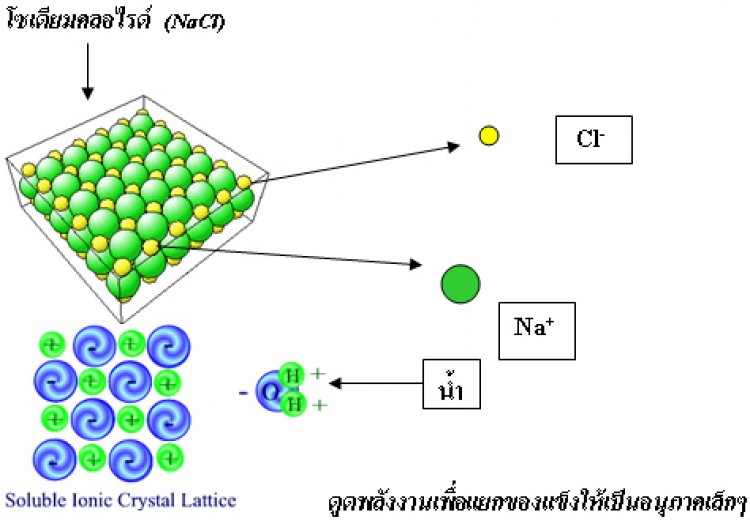
2. อนุภาคของของแข็งรวมตัวกับอนุภาคของของเหลว อนุภาคของแข็งจะกระจายตัวแทรกอยู่ระหว่างอนุภาคของของเหลว แล้วเกิดการสร้างแรงยึดเหนี่ยวระหว่างอนุภาคของของเหลวกับของแข็งและจะมีการคายพลังงานออกมา เรียก พลังงานไฮเดรชัน
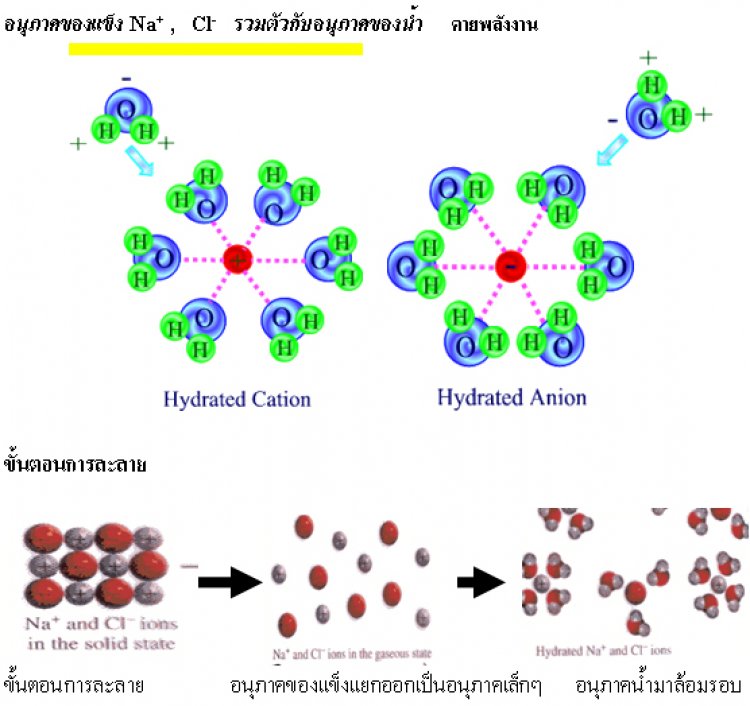
พลังงานการละลาย คือ ผลต่างของพลังงานความร้อนที่ระบบดูดเข้าไปในขั้นที่ 1กับพลังงานความร้อนที่ระบบคายออกมาในขั้นที่ 2
|
ตารางแสดงค่าพลังงานโครงร่างผลึกและพลังงานไฮเดรชันของสารบางชนิด
เครื่องหมาย + แสดงถึงการละลายแบบดูดความร้อน |
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
|
สภาพการละลายได้
ละลายอยู่มากเมื่อเทียบกับปริมาณของตัวทำละลาย
น้อยมากเมื่อเทียบกับปริมาณของตัวทำละลาย
ละลายจำนวนมากที่สุด ณ อุณหภูมิหนึ่งจนไม่สามารถละลายได้อีกแล้ว และความเข้มข้นของตัวถูกละลายในสารละลายอิ่มตัวนี้ เรียกว่า สภาพการละลาย (Solubility) ของสารนั้น
สามารถละลายในตัวทำละลายได้อีก เมื่ออุณหภูมิเพิ่มขึ้น
ฝาขวดน้ำอัดลมจะทำให้แก๊สคาร์บอนไดออกไซด์ละลายได้น้อยลงเพราะการปิดฝาขวดคือการลดความดัน
การเกิดผลึก การตกผลึก (Crystallization) |
||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
กลับไปที่เนื้อหา