เคมีที่เป็นพื้นฐานของสิ่งมีชีวิต
![]()
พันธะเคมีกับพื้นฐานทางเคมีในสิ่งมีชีวิต
1. พันธะไอออนิก (Ionic bond)
- เกิดจากอะตอม 2 อะตอมขึ้นไปให้และรับอิเล็กตรอนกัน
- ตัวให้อิเลกตรอนเรียกว่า ตัวรีดิวซ์ (reducing agent) ตัวรับอิเลกตรอนเรียกว่า ตัวออกซิไดซ์ (oxidizing agent)
- มักเกิดขึ้นระหว่างโลหะกับอโลหะ
- โลหะเมื่อให้อิเล็กตรอนจะมีประจุบวก
- อโลหะเมื่อที่รับอิเล็กตรอนจะมีประจุลบ
- ไอออนที่มีประจุตรงกันข้ามกันจะดึงดูดกันทำให้เกิดพันธะไอออน
- มีความแข็งแรงมากกว่าพันธะไฮโดรเจน แข็งแรงพอๆ กับพันธะโคเวเลนต์
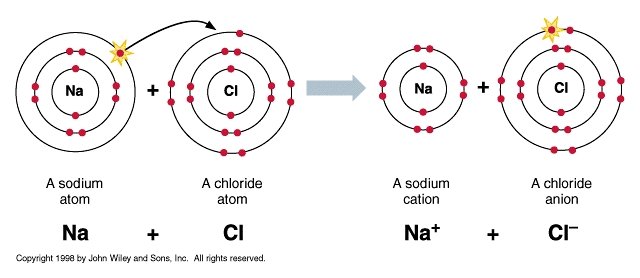
รูปที่ 1. พันธะไอออนิค (ionic bond) เกิดจากการให้เเละรับอิเลกตรอนระหว่างตัวรีดิวซ์เเละตัวออกซิไดซ์ เช่น NaCl เกิดจากอะตอมของ Na ให้electron แก่ Cl กลายเป็น Na+ (reducing agent) ขณะที่ Cl กลายเป็น Cl- (oxidizing agent) ส่งผลให้ electron วงนอกของอะตอม Na และ Cl ครบ 8 กลายเป็นสารประกอบ NaCl
2. พันธะโควาเลนต์ (Covalenะ bond)
- เกิดจากอะตอม 2 อะตอมมีการใช้อิเลกตรอนวงนอกสุดหรือ valence electron ร่วมกันเพื่อ เพื่อให้valence electron ครบ 8 ตามกฎ octet (ยกเว้นไฮโดรเจนที่ครบ 2)
- อะตอมที่เกิดพันธะดังกล่าวจะมีวาเลนซ์อิเล็กตรอนอยู่มากเช่น ธาตุหมู่ VI และหมู่ VII
- พันธะโควาเลนต์แข็งแรงกว่าพันธะไฮโดรเจน และมีความแข็งแรงพอๆ กับพันธะไอออนิก
- มักเกิดขึ้นระหว่างอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีใกล้เคียงกัน
- ธาตุอโลหะมีแนวโน้มที่จะสร้างพันธะโควาเลนต์มากกว่าธาตุโลหะซึ่งมักสร้างพันธะโลหะ
- อิเล็กตรอนของธาตุโลหะสามารถเคลื่อนอย่างอิสระส่วนอิเล็กตรอนของธาตุอโลหะไม่สามารถเคลื่อนที่ได้อย่างอิสระนัก การใช้อิเล็กตรอนร่วมกันจึงเป็นทางเลือกเดียวในการสร้างพันธะกับธาตุที่มีสมบัติคล้ายๆ กัน
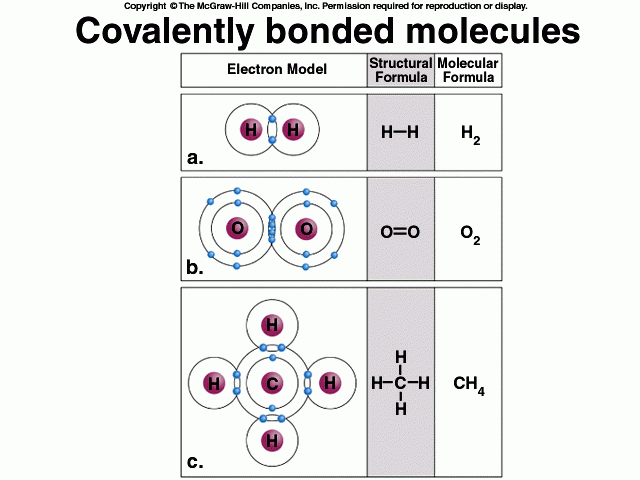
รูปที่ 2. Covalent bond เป็นพันธะที่เกิดจากการใช้ electron ร่วมกันของ 2 อะตอม เช่น ก๊าซไฮโดรเจน (H2) ออกซิเจน (O2) น้ำ (H2O) และมีเทน (CH4) เป็นต้น โดยการเเชร์อิเลกตรอนรวมกัน 1 คู่จะเเสดงแขนพันธะ 1 เเขน
พันธะโควาเลนต์เเบ่งออกได้เป็น 2 แบบ (ตามรูปที่ 3)
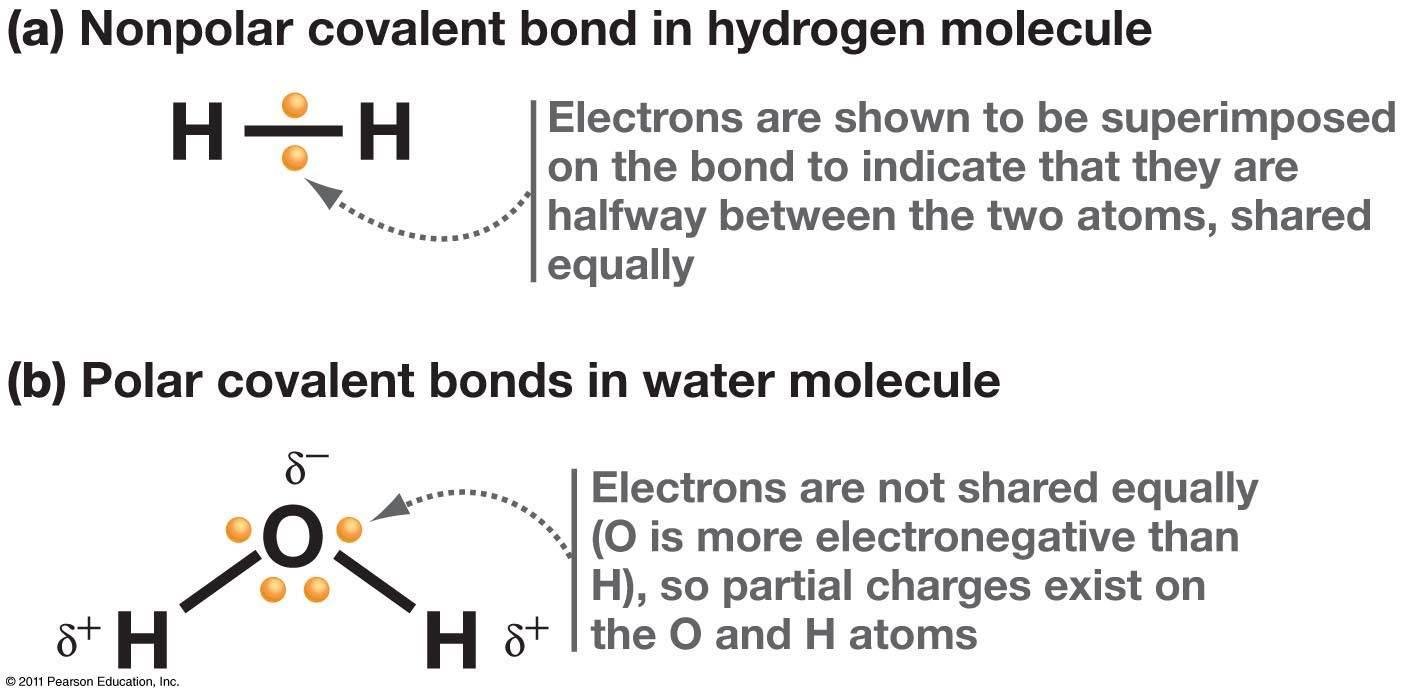
รูปที่ 3. เเสดงการมีขั้วกับไม่มีขัวของพันธะโควาเลนต์
- nonpolar covalent เป็นการใช้อิเล็กตรอนร่วมกัน โดยอิเล็กตรอนวิ่งรอบอะตอมทั้งสองเท่ากัน เช่น H2 ,O2 และ CH4
- polar covalent เป็นการใช้อิเล็กตรอนร่วมกันโดยอะตอมที่มี electronegativity สูง จะดึงอิเล็กตรอนมาใกล้ตัวมากกว่า จึงทำให้มีประจุ เช่น H2O โดย O มีค่า EN. สูงสามารถดึงอิเล็กตรอนเข้ามาวน รอบตัวเองได้มากกว่า H จึงทำให้ O เป็นลบ H เป็นบวก
3. พันธะไฮโดรเจน (HYDROGEN BOND)
- เป็นพันธะระหว่างโมเลกุลที่แข็งแรงมากกว่าพันธะระหว่างโมเลกุลเเบบอื่นๆ (ย้ำนะครับมันไม่ใช่พันธะภายในนะจึงเเข็งเเรงไม่เท่าพันธะโควาเลนต์เเละพันะธะไอออนิก เห็นมักจะเข้าใจผิดกันบ่อย)
- เกิดจากไฮโดรเจนกับธาตุที่มีค่าอิเล็กโตรเนกาติวิตีสูง ได้แก่ ออกซิเจน (O) ฟลูออรีน (F) และไนโตรเจน (N)
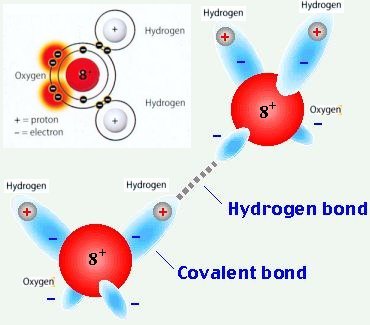
รูปที่ 4. แสดงพันธะไฮโดรเจนระหว่างโมเลกุลของน้ำ เเต่หากเป็นไฮโดรเจนที่จับกับออกซิเจนภายในดมเลกุลจะเป็นพันธะโควาเลนต์
4. แรงวัลเดอร์วาลส์ (Van der Waals interaction) เป็นแรงดึงดูดระหว่างโมเลกุลหรือภายในโมเลกุลเดียวกัน มีผลทำให้เกิดรูปร่างของโมเลกุล
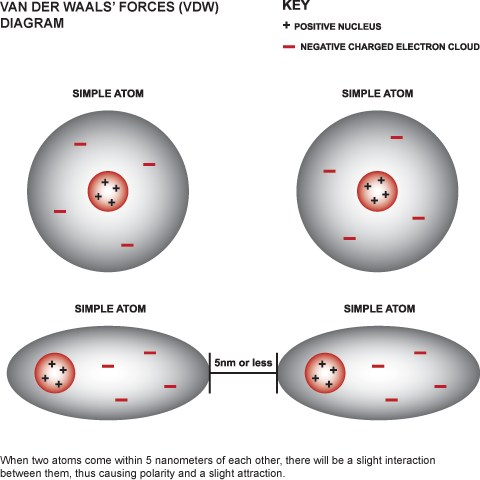
รูปที่ 5. แสดง Van der Waals interaction (ที่มา http://www.zmescience.com/science/physics/direct-measurement-of-van-der-waals-force-made-for-the-first-time/)
5. แรงดึงดูดระหว่างโมเลกุลที่ไม่ชอบน้ำ (hydrophobic interaction) เช่น หยดน้ำมันเล็กๆลงในน้ำ หยดน้ำมันเหล่านี้ จะรวมกันเป็นหยดใหญ่เพื่อสัมผัสกับน้ำน้อยที่สุด แรงดึงดูดระหว่างหยดนี้คือ hydrophobic interaction ระหว่างโมเลกุล
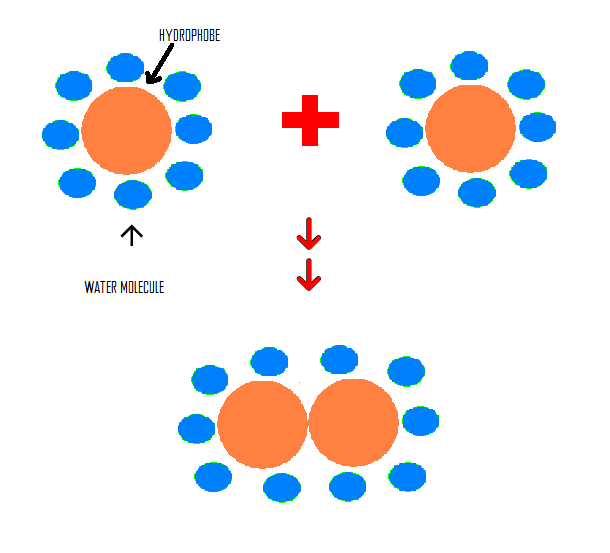
รูปที่ 6. เเสดงการรวมตัวของ hydrophobic molecule ที่เกิดจากเเรง hydrophobic interaction
(ที่มาhttp://chemwiki.ucdavis.edu/Physical_Chemistry/Physical_Properties_of_Matter/Atomic_and_Molecular_Properties/Intermolecular_Forces/Hydrophobic_interactions)
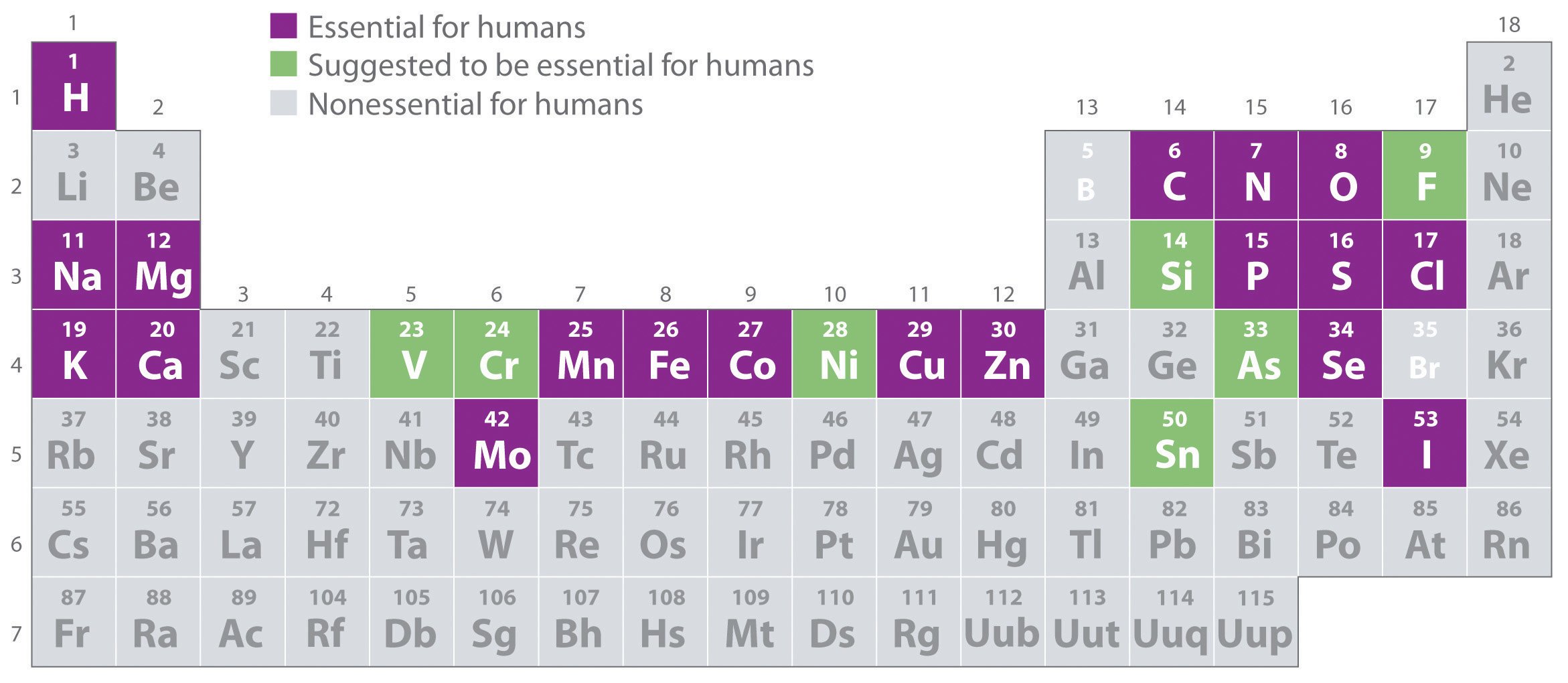
รูปที่ 7. เเสดงเเร่ธาตุต่างๆที่สำคัญของร่างกาย สีม่วงสำคัญเเละจำเป็นต่อร่างกาย สีเขียวจำเป็น
กลับไปที่เนื้อหา
น้ำเป็นสารอนินทรีย์ที่สำคัญของร่างกาย (Inorganic molecule)
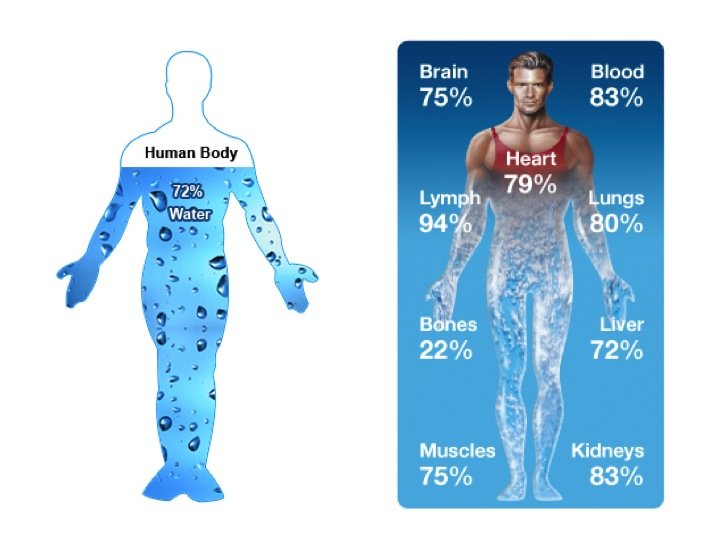
ภาพที่ 1 เเสดงองค์ประกอบขอน้ำในอวัยวะต่างๆที่เเตกต่างกันร่างกายของเราประกอบด้วยน้ำเป้นองค์ประกอบหลัก อวัยวะเเต่ละส่วนมีองค์ประกอบของน้ำเเตกต่างกัน
น้ำ H2O • เซลล์มีน้ำเป็นส่วนประกอบอยู่ภายใน 70 – 90% • ไม่มีสี ไม่มีกลิ่น และไม่มีรส • 1 โมเลกุลประกอบด้วย H 2 อะตอม และ O 1 อะตอม
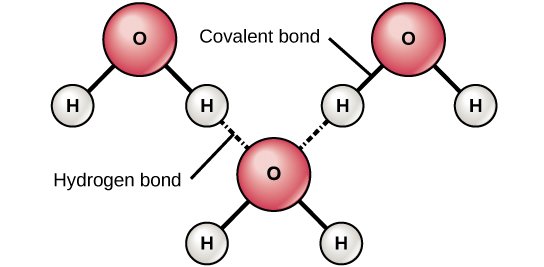
รูปที่ 2 เเสดงพันธะโควาเลนต์ซึ่งเป็นพันธะภายในโมเลกุลของน้ำที่เเข็งเเรงกว่าพันธะไฮโดรเจนซึ่งเป็นพันธะระหว่างโมเลกุล• พันธะเชื่อมต่อกันภายในโมเลกุลคือ Covalent bonds H และ O อะตอมเรียงทำมุม 105 องศา • แต่ละโมเลกุลของน้ำเชื่อมกันด้วย Hydrogen bonds ทำให้โครงสร้างเรียงตัวต่อกันเป็นรูปจัตุรมุข
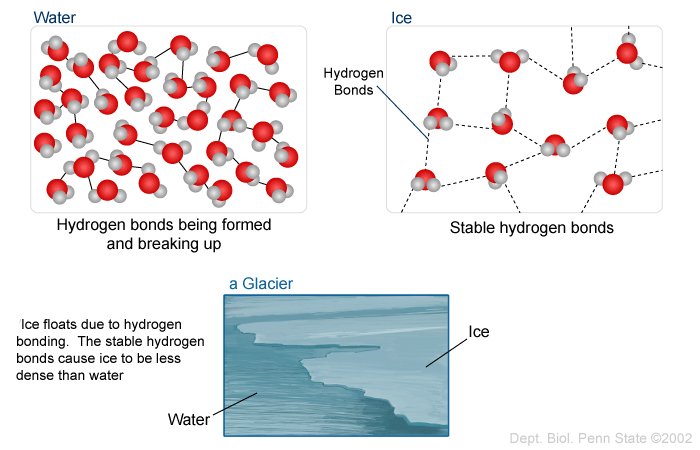
รูปที่ 3 เมื่อเพิ่มความร้อนให้กับน้ำแข็ง H-bonds ที่เชื่อมระหว่างโมเลกุลจะถูกทำลาย น้ำในสถานะของเหลวจึงใช้เนื้อที่น้อยกว่าน้ำแข็ง คือสาเหตุให้น้ำแข็งจึงมีความหนาแน่นต่ำกว่าน้ำ
ความสำคัญของน้ำ
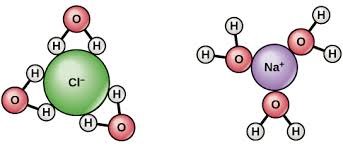
รูปที่ 4 เเสดงการรวมตัวของน้ำเเละเกลือ NaCl1. มีสภาพเป็นขั้วจึงเป็นตัวทำละลายที่ดี เช่น เกลือ NaCl ละลายในน้ำได้ เนื่องจากโมเลกุลของน้ำมี O เป็นประจุลบ และ H ประจุบวก ดังนั้น O- จึงจับกับ Na+ ขณะที่ H+ จับกับ Cl- สารที่ชอบน้ำ เรียกว่า hydrophilic ส่วนสารที่ไม่ชอบน้ำ เรียกว่า hydrophobic
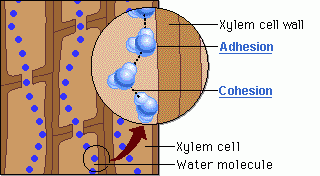
รูปที่ 5 เเสดงเเรงยึดเหนี่ยวระหว่างโมเลกุลของน้ำกับสารต่างๆ
2. เกิด hydrogen bond ระหว่างโมเลกุลของน้ำทำให้น้ำเคลื่อนที่จากรากไปยังส่วนต่างๆ ของพืชได้cohesion = แรงดึงดูดระหว่างโมเลกุลชนิดเดียวกันadhesion = แรงดึงดูดระหว่างโมเลกุลที่ต่างกัน3. มีความร้อนจำเพาะสูง ทำให้ metabolism ภายในเซลล์ยังคงปกติเนื่องจากอุณหภูมิภายในเซลล์สิ่งมีชีวิตเปลี่ยนแปลงไม่มาก4. ความร้อนแฝงกลายเป็นไอสูง เมื่อร่างกายสูญเสียเหงื่อ หรือการที่พืชคายน้ำ จึงช่วยลดความร้อนภายในสิ่งมีชีวิตได้
กลับไปที่เนื้อหา
แร่ธาตุคืออะไร
แร่หรือสารประกอบอนินทรีย์ที่เป็นองค์ประกอบของอาหารส่วนที่เหลือเป็นเถ้าหลังจากการเผาไหม้ สารอินทรีย์ทั้งหมดในเนื้อเยื่อพืชและสัตว์
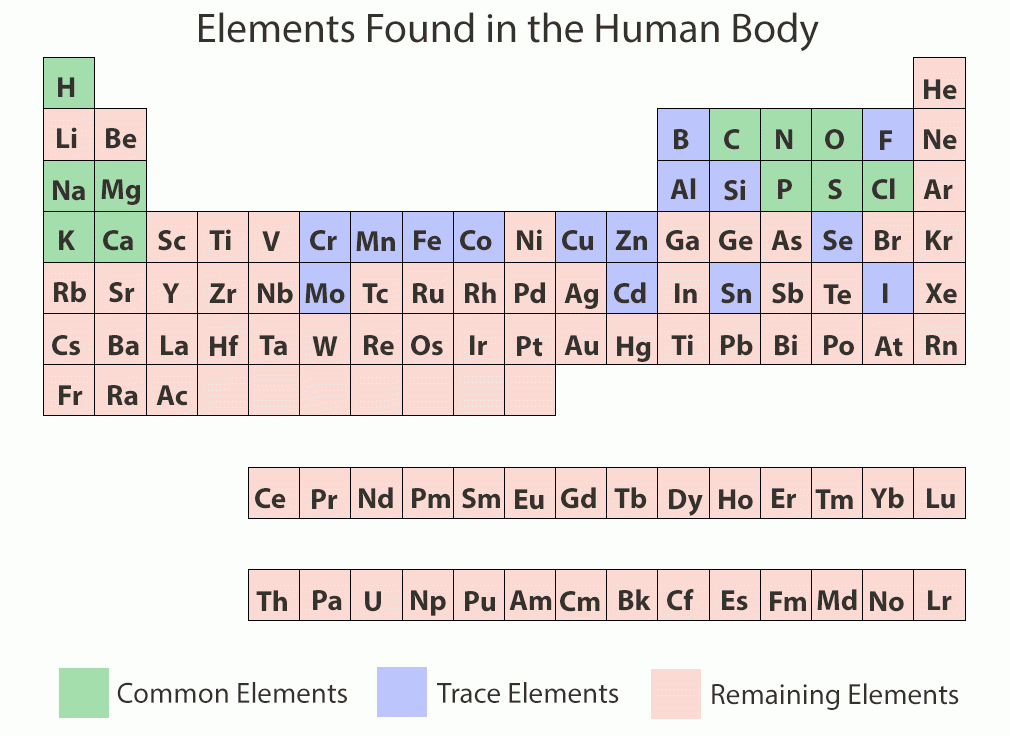
รูปที่ 1 เเสดงธาตุหลักที่พบในร่างกาย (สีเขียว) ธาตุที่พบในปริมาณน้อย (สีม่วง)https://askabiologist.asu.edu/content/atoms-lifeความสำคัญของแร่ธาตุ (IMPORTANCE OF MINERALS)• พบเป็นส่วนประกอบเพียงประมาณ 4 เปอร์เซ็นต์ของน้ำหนักร่างกาย
- ทำหน้าที่เป็นโคแฟคเตอร์ในการทำงานของเอนไซม์
- มีความจำเป็นต่อระบบการทำงานของประสาท
- รักษาสมดุลของน้ำในร่างกายและความเป็นกรดเป็นด่างในร่างกาย
- ควบคุมการหดรัดตัวของกล้ามเนื้อ
- ช่วยในการแข็งตัวของเลือด
แร่ธาตุแบ่งออกเป็น 2 ประเภท
1.แร่ธาตุหลัก (major / macro minerals) แร่ธาตุที่ร่างกายต้องการมากกว่า 100 มิลลิกรัมต่อวัน
2.แร่ธาตุรองหรือแร่ธาตุปลีกย่อย (minor / micro minerals) แร่ธาตุที่ร่างกายต้องการน้อยกว่า 100 มิลลิกรัมต่อวัน
แร่ธาตุหลัก (MACROMINERALS)
- อาจเรียกว่าแร่ธาตุหลัก (major minerals)
- ร่างกายมีความต้องการอย่างน้อย 0.01 เปอร์เซ็นต์ของน้ำหนักตัว
- พบอยู่ในร่างกายในปริมาณอย่างน้อย 5 กรัม (คนที่มีน้ำหนักตัว 60 กิโลกรัม)
- เกลือแร่หลักพบในร่างกายได้แก่ Ca, P, Mg, Na, K และ Cl
- ทำหน้าที่สำคัญหลายๆอย่างในร่างกาย

ตารางที่ 1 เเสดงเเร่ธาตุหลักที่พบในร่างกายเเละอาการเมื่อขาด
จุลแร่ธาตุ (MICROMINERALS)
- อาจเรียกว่า trace minerals หรือ trace elements หรือ essential elements
- นิยามคำว่า trace และ essential
- เป็นเกลือแร่ที่ประกอบอยู่น้อยกว่า 0.01 เปอร์เซ็นต์ของน้ำหนักตัวทั้งหมด
- ร่างกายต้องการในปริมาณ 1 ส่วนใน 1,000,000 ส่วน (1 ppm.) หรือน้อยกว่านี้
- ตัวอย่างเช่นร่างกายต้องธาตุเหล็ก (Fe) เพียง 1-2 มิลลิกรัมต่อวัน
- หากร่างกายได้รับในปริมาณไม่เพียงพออาจทำให้การทำงานทางชีวภาพต่ำกว่าปกติ
- การได้รับเกลือแร่ในปริมาณปกติหรือเสริมเข้าไปสามารถทำให้ความผิดปกติหายไปได้
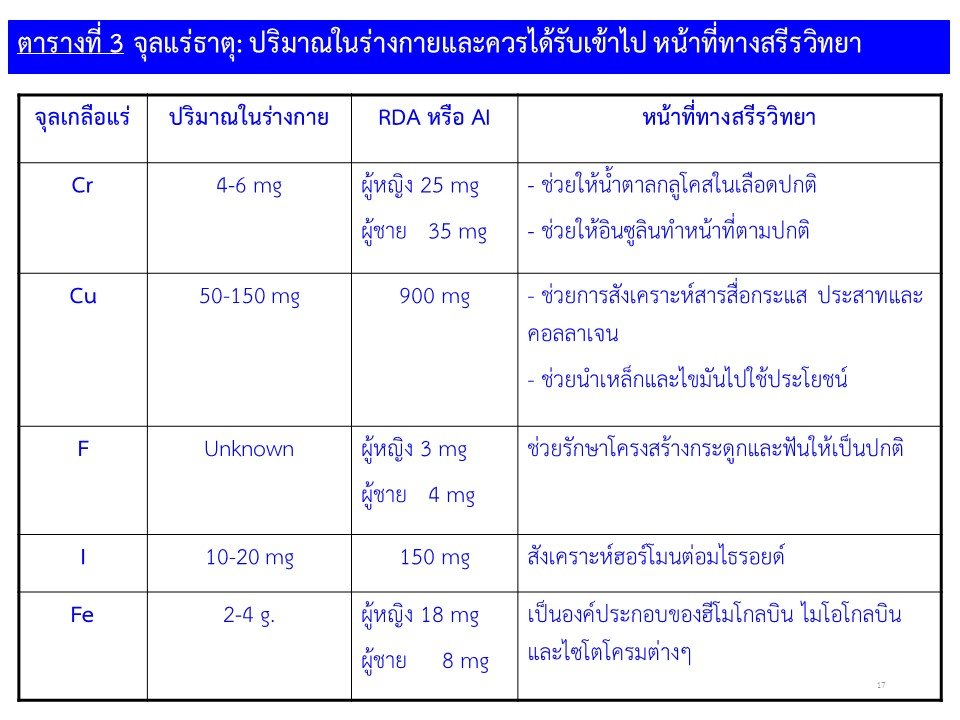
ตารางที่ 2 เเสดงตัวอย่างธาตูอาหารรองและหน้าที่
กลับไปที่เนื้อหา
โปรตีน (Protein)
โปรตีน มีหน้าที่หลายอย่าง ดังนี้
1. เป็น enzyme หรือ biocatalyst เพื่อเร่งปฏิกิริยาเคมี
2. เป็นโปรตีนโครงสร้าง เช่น พวก collagen , elastin , keratin
3. เป็นตัวขนส่ง (transporter) เช่น hemoglobin หรือ โปรตีนที่ plasma membrane
4. เป็นฮอร์โมน เช่น insulin
5. เกี่ยวข้องกับภูมิคุ้มกัน เช่น เป็น antibody
6. ทำหน้าที่เกี่ยวกับการเคลื่อนไหว Acin และ myosin ในกล้ามเนื้อ
สารประกอบขนาดใหญ่ (macromolecules) ในสิ่งมีชีวิต จัดเป็น 4 กลุ่มตามลักษณะโครงสร้างของโมเลกุล ได้แก่
Carbohydrate ประกอบด้วยธาตุ C, H, O
Protein “ C, H, O, N
Lipid “ C, H, O
Nucleic acid “ C, H, O, N, P
ปฏิกิริยาเคมีของ macromolecules ได้แก่
1. Condensation (dehydration reaction หรือ dehydration synthesis) ปฏิกิริยาสังเคราะห์ macromolecules จาก monomers ที่มีหมู่ฟังก์ชันมากกว่า 1 หมู่ และได้ผลผลิตเป็น H2O, CH3OH, HCl
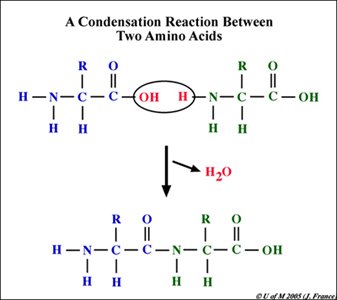
รูปที่ 1 เเสดงปฎิกิริยา condensation ระหว่างกรดอะมิโน 2 ตัว
2. Hydrolysis ปฏิกิริยาที่มีน้ำเข้าไปสลายพันธะ ทำให้สารโมเลกุลใหญ่ แตกตัวเป็นสารที่มีโมเลกุลเล็กลง เพื่อให้สามารถนำผ่านเยื่อหุ้มเซลล์เข้าสู่เซลล์ได้ หรือย่อยสลาย macromolecules ที่ไม่ใช้แล้วภายในเซลล์
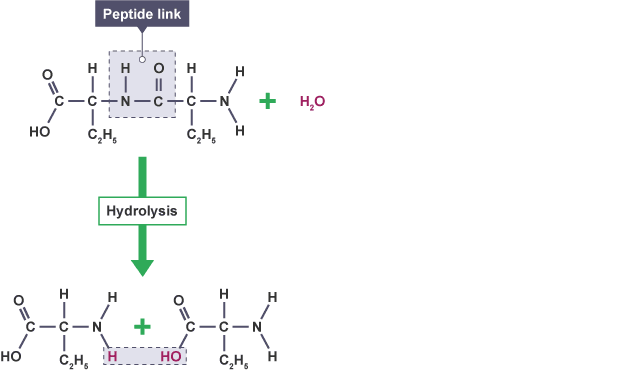
รูปที่ 2 เเสดงปฎิกิริยาการเเยกสลายไดเพปไทด์โดยอาศัยโมเลกุลของน้ำเข้าร่วมทำปฎิกิริยา
Amino acid
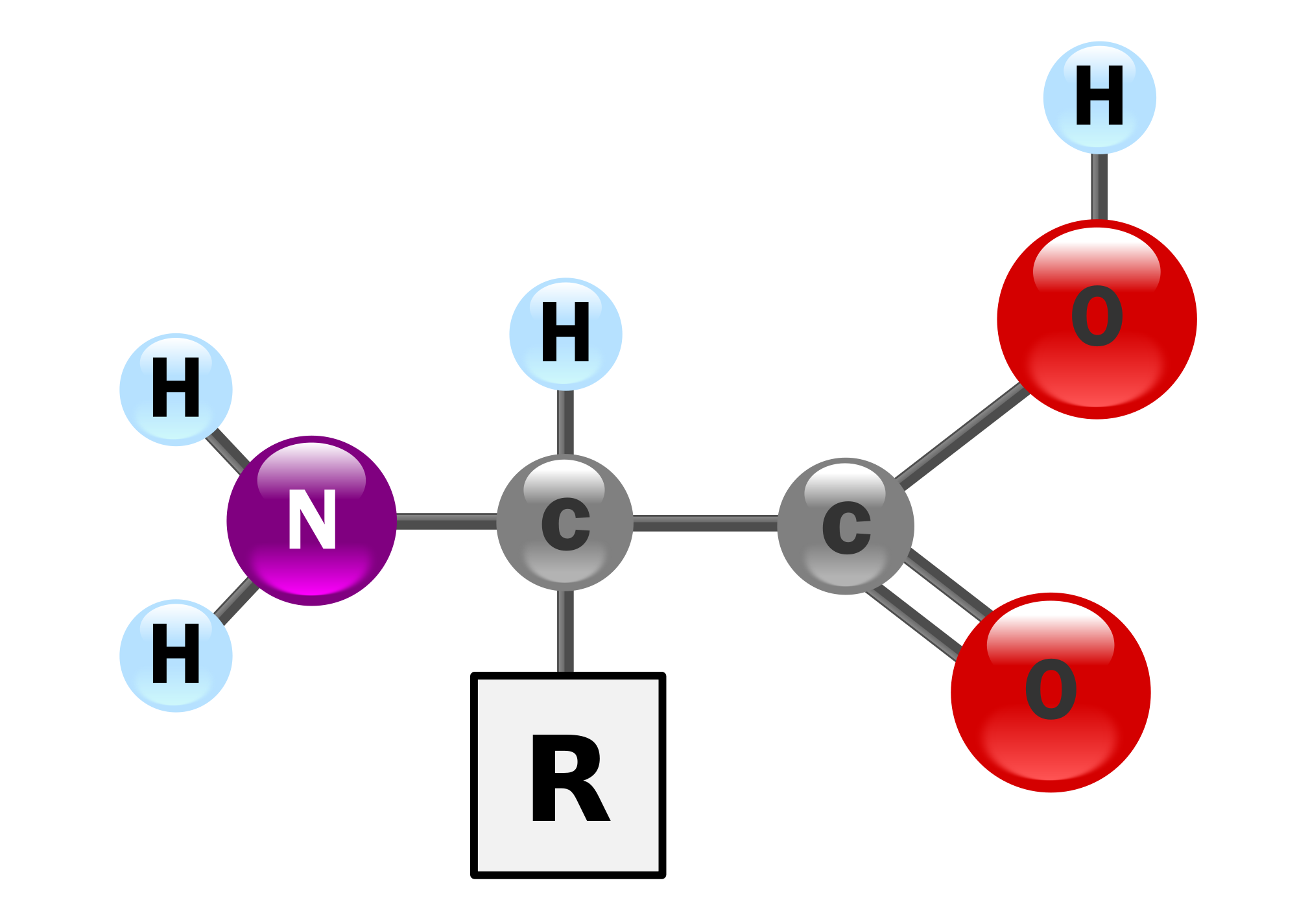
รูปที่ 3 เเสดงโครงสร้างของกรดอะมิโน
โปรตีนมีหน่วยย่อยเป็น กรดอะมิโน (amino acid) ประกอบด้วย
- หมู่คาร์บอกซิล (-carboxyl)
- หมู่อะมิโน (-NH2)
- หมู่แอลคิล (-R)
กรดอะมิโน แบ่งได้เป็น 2 ประเภท
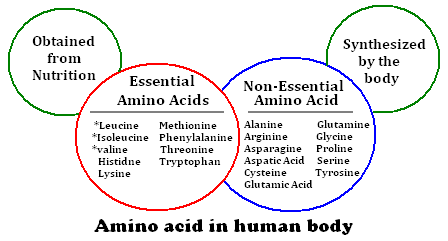
1. กรดอะมิโนจำเป็น (essential amino acid) คือ กรดอะมิโนที่ร่างกายต้องการแต่ไม่สามารถสร้างเองได้ต้องอาศัยการรับประทานอาหารเข้าไป
2. กรดอะมิโนไม่จำเป็น (non-essential amino acid) คือกรดอะมิโนที่ร่างกายสามารถสร้างเองได้ ไม่จำเป็นต้องได้รับจากอาหาร
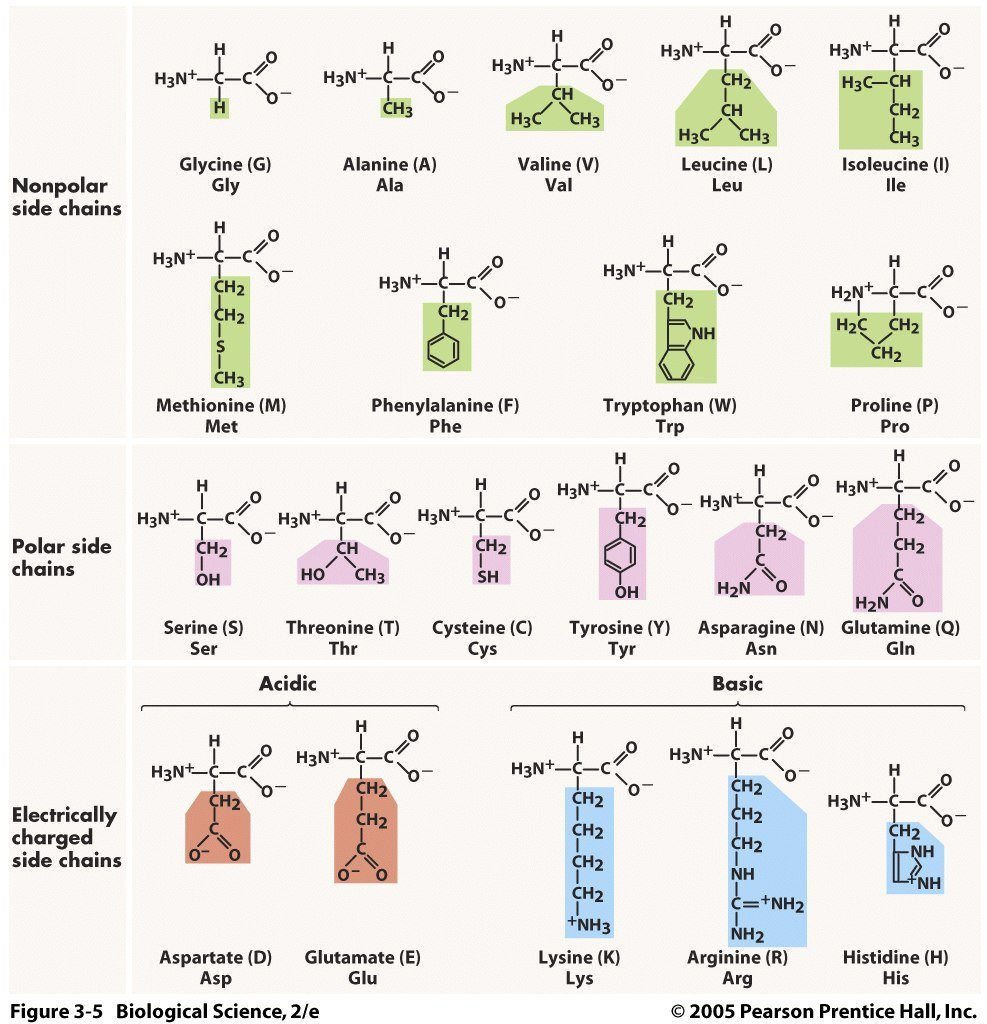
กรดอะมิโนแต่ละชนิดที่แตกต่างๆ กันเฉพาะในหมู่ R- ที่เรียกว่า Side chain กรดอะมิโนแบ่งตามสภาพขั้วของหมู่ R- ออกเป็น 4 ประเภท คือ
1. กรดอะมิโนที่มีหมู่ R- ไม่มีขั้ว
2. กรดอะมิโนที่มีหมู่ R- มีขั้วและมีสมบัติเป็นกลาง
3. กรดอะมิโนที่มีหมู่ R- มีสมบัติเป็นกรด
4. กรดอะมิโนที่มีหมู่ R- มีสมบัติเป็นเบส
Protein
เป็น polypeptide ของ amino acid ที่ต่อกันเป็นลำดับเฉพาะตัวสำหรับโปรตีนแต่ละชนิดโปรตีนสามารถทำงานได้ ต้องมีรูปร่าง (conformation) ที่เป็นลักษณะเฉพาะตัวมนุษย์มีโปรตีนมากกว่า 10,000 ชนิด แต่ละชนิดมีโครงสร้างและหน้าที่แตกต่างกัน
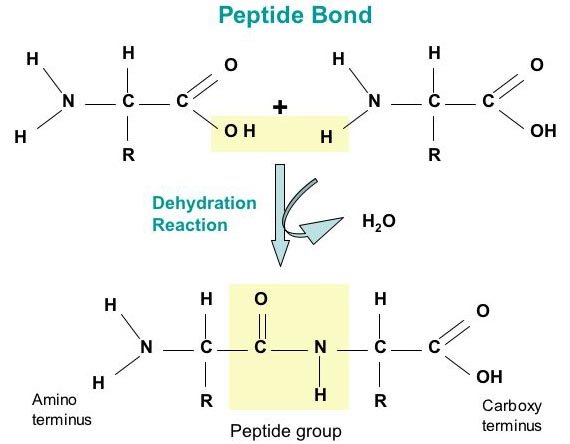
Amino acid ต่อกันเป็นสายยาวด้วย covalent bond เรียกว่า peptide bond
- ปลายที่มีหมู่ amino เรียกว่า N-terminus
- ปลายที่มีหมู่ carboxyl เรียกว่า C-terminus
ประเภทของโปรตีน แบ่งออกเป็น 2 ประเภท
1. โปรตีนเส้นใย (fibrous protein)
- พอลิเพปไทด์สายยาวๆ หลายเส้นมาเวียนพันกันเป็นวง helix
- อาศัยแรงยึดกันระหว่างสาย
- มีลักษณะเป็นเส้นใย (fiber) หรือเป็นแผ่น (sheet)
- มีความแข็ง เหนียว และอาจจะยืดหยุ่นได้
- ไม่ละลายในน้ำ
◦ คอลลาเจน (collagen) ของเอ็น (tendon)
◦ เมทริกซ์ (matrix) ของกระดูก
◦ คีราทิน (keratin) ของเส้นผม ขน เขา และเล็บ
◦ ไฟโบรอิน (fibroin) ของเส้นไหม
◦ อีลาสติน (elastin) ให้ความแข็งแรงและรับแรงยืดหยุ่นในเนื้อเยื่อเกี่ยวกัน
2. โปรตีนกลอบูลาร์ (globular protein)
- พอลิเพปไทด์ขดม้วนแน่นในลักษณะกลม
- โครงสร้างประกอบด้วย
◦ เกลียวอัลฟา (α-helix) และ เบตาชีทเพลท (β-sheet plate) ในปริมาณต่างๆ กัน
- โปรตีนนี้ส่วนใหญ่ละลายในน้ำได้ เช่น
- เช่น insulin, albumin, globulin, enzyme ต่างๆ
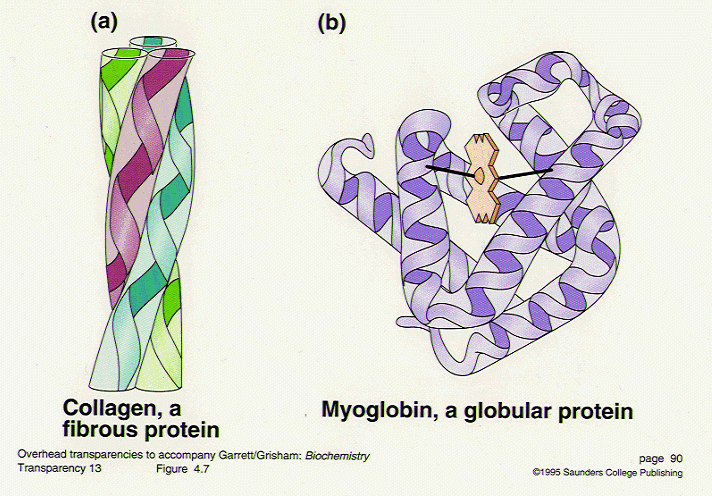
รูปที่ 7 แสดงประเภทของโปรตีน
โครงสร้างของโปรตีน (protein structure) มี 4 ระดับ คือ
1. โครงสร้างปฐมภูมิ (primary structure) การเรียงลำดับของกรดอะมิโนในสาย polypeptide
2. โครงสร้างทุติยภูมิ (secondary structure) มีการสร้าง H-bond ระหว่างกรดอะมิโนทำให้มีการขดเป็น helix หรือพับทบไปทบมาเป็น sheet
3. โครงสร้างตติยภูมิ (tertiary structure) หมายถึงโครงรูปของสาย polypeptide ทั้งสายซึ่งประกอบด้วย secondary structure หลายสายรวมกัน โดยเกิดพันธะต่าง ๆ ภายในสาย secondary structure ได้แก่ พันธะ ionic , hydrogen และ hydrophobic เป็นต้น
4. โครงสร้างจุตรภูมิ (quaternary structure) แต่ละ polypeptide มาอยู่รวมกันเพื่อทำหน้าที่ เช่น hemoglobin ประกอบด้วยสาย polypeptide ชนิด a และ b อย่างละ 2 สายมาอยู่รวมกัน
โครงสร้างของโปรตีน
1. โครงสร้างปฐมภูมิ (primary structure)
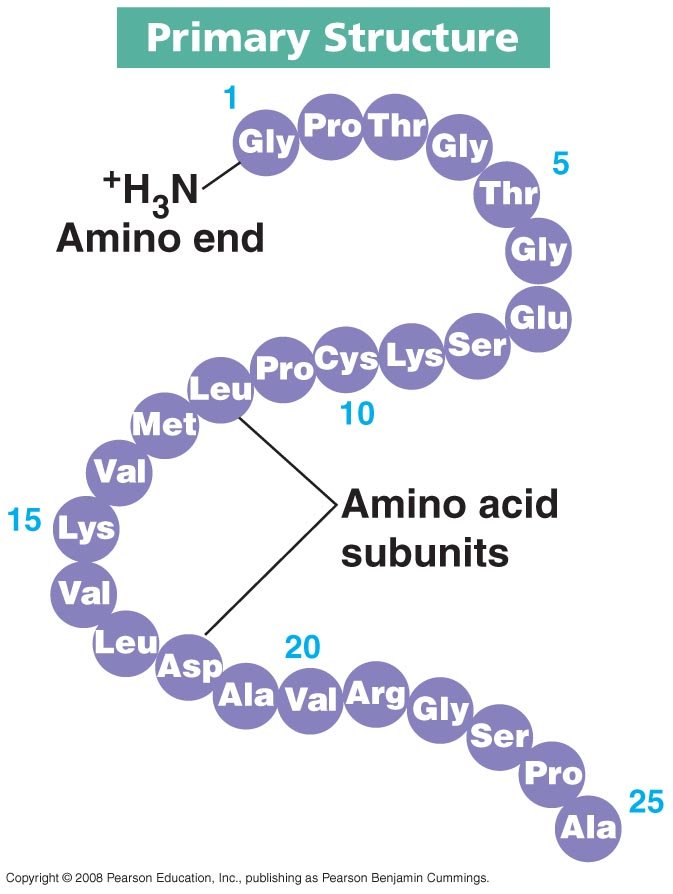
-กรดอะมิโนเรียงตัวเป็นสายโซ่พอลิเพปไทด์ที่จำเพาะ
การเปลี่ยนแปลงลำดับ amino acid ในโปรตีนอาจมีผลให้รูปร่างของโปรตีนเปลี่ยนไป และอาจมีผลต่อการทำงานของโปรตีนชนิดนั้นๆ
ตัวอย่างเช่น โรค sickle-cell anemia
2. โครงสร้างทุติยภูมิ (The secondary structure of a protein)
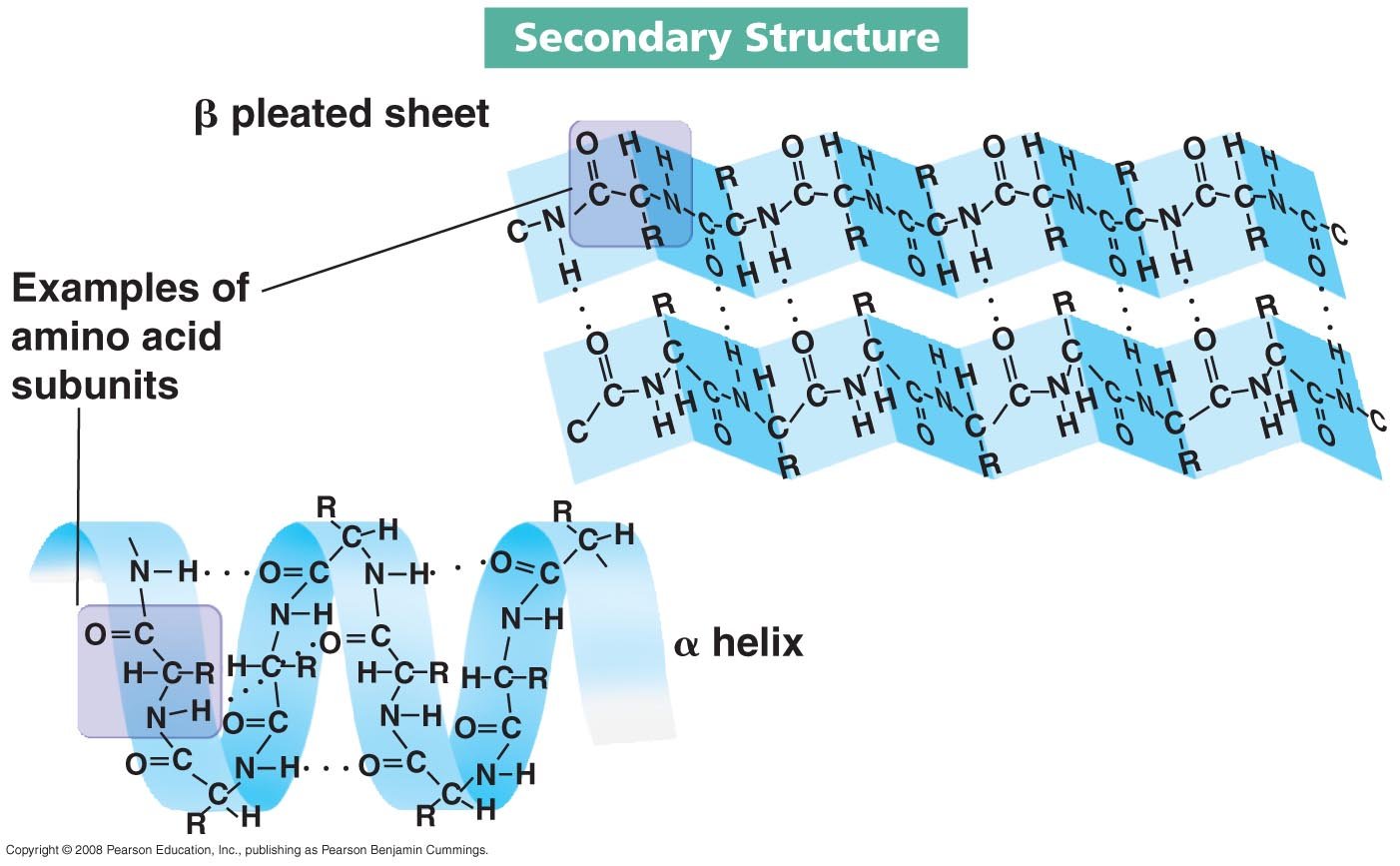
- Ø โครงสร้างเกิดขึ้นจาก H-bond ระหว่างหมู่ carboxylและหมู่ amino
- Ø พบบ่อยในธรรมชาติได้แก่ a-Helix และ b Pleated sheet
ตัวอย่างเช่น เส้นใยแมงมุม มีโครงสร้างแบบ b-Pleated sheet ทำให้เส้นใยแมงมุมมีความแข็งแรงมาก
3. โครงสร้างตติยภูมิ (tertiary structure)
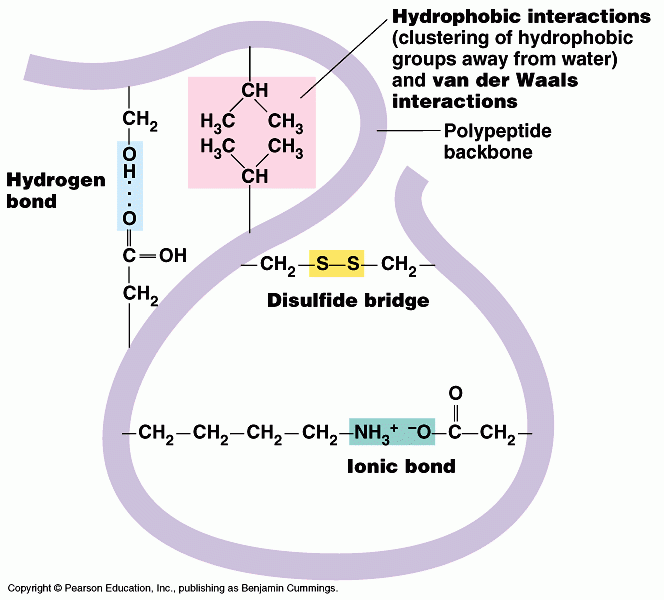
โครงสร้างประกอบด้วยpolypeptide หนึ่งสายม้วนพับไปมาขึ้นอยู่กับแรงยึดเหนี่ยวระหว่าง R group ด้วยกันเอง หรือ R group กับโครงสร้างหลัก
แรงยึดเหนี่ยว หมายถึง H-bond Ionic bond Hydrophobic interaction Van der Waals interaction
บางตอนยึดติดกันด้วย covalent bond ที่แข็งแรง เรียกว่า disulfide bridges
4. โครงสร้างจตุรภูมิ (quaternary structure)
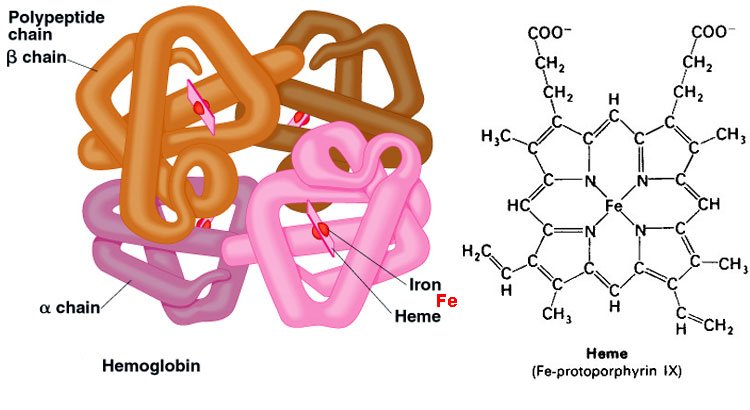
รูปที่ 10 แสดงHemoglobin ประกอบด้วย polypeptide 4 สายรวมกันกลายเป็นโปรตีนที่มีรูปร่างเป็นก้อน ประกอบด้วยอัลฟายูนิต 2 หน่วยและเบตา 2 ยูนิต
Collagen เป็น fibrous protein ประกอบด้วย polypeptide 3 สายพันกันอยู่ ซึ่งทำให้โปรตีนชนิดนี้มีความแข็งแรงและพบใน connective tissue
◦ เกิดจาก tertiary structure ของ polypeptide มารวมกันมากกว่า 1 สายด้วย
◦ พันธะไฮโดรเจน
◦ พันธะไฮโดรโฟบิก
◦ แรงแวนเดอร์วาลส์
◦ เรียกโปรตีนที่มีโครงสร้างลักษณะนี้ว่า โอลิโกเมอริกโปรตีน (oligomeric protein) เช่น ฮีโมโกลบิน คอลลาเจน
สมบัติของโปรตีน
1. การละลายน้ำ ไม่ละลายน้ำ บางชนิดละลายน้ำได้เล็กน้อย
2. ขนาดโมเลกุลและมวลโมเลกุล ขนาดใหญ่มีมวลโมเลกุลมาก
3. สถานะ ของแข็ง
4. การเผาไหม้ เผาไหม้มีกลิ่นไหม้
5. การทำลายธรรมชาติ โปรตีนบางชนิดเมื่อได้รับความร้อน หรือเปลี่ยนค่า pH หรือเติมตัวทำลายอินทรีย์บางชนิด จะทำให้เปลี่ยนโครงสร้างจับเป็นก้อนตกตะกอน
6. การทดสอบโปรตีน
- สารละลายไบยูเรต เป็นสารละลายผสมระหว่าง CuSO4 กับ NaOH เป็นสีฟ้า
- ทำปฏิกิริยากับกรดไนตริกจะเกิดสีเหลือง
สมบัติทั่วไปของกรดอะมิโน
1. สถานะ เป็นของแข็งถ้าบริสุทธิ์จะเป็นผลึก ไม่มีสี
2. การละลาย กรดอะมิโนสามารถละลายน้ำได้ดี ( เป็นโมเลกุลมีขั้ว ) เกิดแรงยึดเหนี่ยวระหว่างโมเลกุล เป็นพันธะไฮโดรเจน และแรงแวนเดอร์วาลส์
3. จุดหลอมเหลวสูง โดยมากมักจะสลายตัวที่อุณหภูมิระหว่าง 150 - 300 องศาเซลเซียส
4. ความเป็นกรดเบส กรดอะมิโนมีสมบัติเป็นได้ทั้งกรดและเบส เรียกว่า สารแอมโฟเทอร์ริก ( Amphoteric substance )
5. กรดอะมิโนมีหมู่ฟังก์ชัน 2 แบบ คือ หมู่คาร์บอกซิล และหมู่อะมิโน ดังนั้นจึงแสดงสมบัติทางเคมีตามหมู่ฟังก์ชันทั้ง 2 แบบคือ แสดงสมบัติคล้ายกรดอินทรีย์ และเอมีน
6. กรดอะมิโนสามารถทำปฏิกิริยากันได้ โดยใช้หมู่อะมิโนของกรดอะมิโนโมเลกุลหนึ่งทำปฏิกิริยากับหมู่คาร์บอกซิลของกรดอะมิโนของอีกโมเลกุลหนึ่ง ได้สารประกอบพวกเพปไทด์
Denaturation and renaturation of a protein
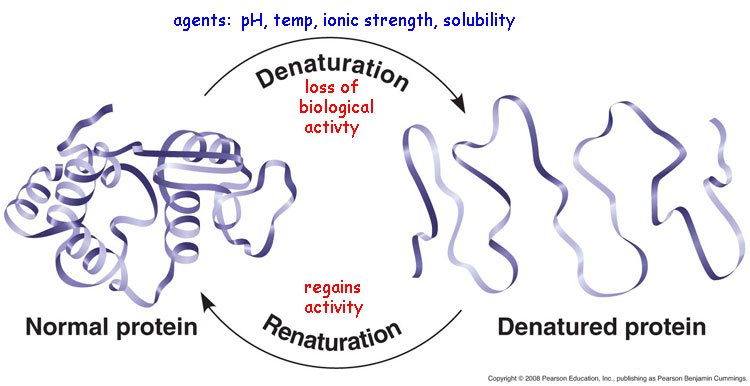
- รูปร่างของโปรตีนบางชนิดสามารถเปลี่ยนแปลงได้ ถ้าสภาพแวดล้อมของโปรตีนเปลี่ยนไป เนื่องจากแรงยึดเหนี่ยวต่างๆระหว่าง amino acid ในสาย polypeptide ถูกทำลาย การเปลี่ยนแปลงนี้เรียกว่า Denaturation
- โปรตีนบางชนิดเมื่อเกิด denaturation แล้ว ยังสามารถกลับคืนสู่สภาพเดิมได้ เรียกว่า Renaturation
การทำลายสภาพธรรมชาติ
การทำลายสภาพธรรมชาติของโปรตีน คือ กระบวนการอย่างหนึ่งที่ทำให้โครงสร้างของโปรตีนเปลี่ยนไป
สิ่งที่ทำลายสภาพของโปรตีน
1. ความร้อน และรังสีอุลตราไวโอเลต
2. ถูกตัวทำละลายอินทรีย์ เช่น เอทานอล อะซีโตน
3. ความเป็นกรด หรือความเป็นเบส
4. รวมตัวกับเกลือของโลหะหนัก เช่น Hg2+ Ag+
5. การฉายรังสีเอ็กซ์
6. การเขย่าแรงๆ ให้ตกตะกอน
ความสำคัญของโปรตีนต่อสิ่งมีชีวิต เป็นสารสำคัญในการสร้างและซ่อมแซมร่างกาย และทำให้ร่างกายแข็งแรง เป็นส่วนประกอบของสารที่ใช้ควบคุมปฏิกิริยาเคมีต่างๆ และการทำงานของอวัยวะต่างๆ ในร่างกายเป็นสารที่ใช้สำหรับต่อต้านโรคใช้ในการขนส่งสารเคมีในเลือดให้พลังงานและความร้อน
กลับไปที่เนื้อหา



