ฟิสิกส์อะตอม
อะตอม
“อะตอม” เป็นคำซึ่งมาจากภาษากรีกแปลว่าสิ่งที่เล็กที่สุด ซึ่งนักปราชญ์ชาวกรีกโบราณที่ชื่อ ลูซิพปุส และดิโมคริตุส ใช้สำหรับเรียกหน่วยที่เล็กที่สุดของสสาร ที่ไม่สามารถแบ่งแยกต่อไปได้อีก โดยเขาได้พยายามศึกษาเกี่ยวกับวัตถุที่มีขนาดเล็ก (ฟิสิกส์ระดับจุลภาค, microscopic) และมีแนวคิดเกี่ยวกับโครงสร้างของสสารว่า สสารทั้งหลายประกอบด้วยอนุภาคที่เล็กที่สุด จะไม่สามารถมองเห็นได้ และจะไม่สามารถแบ่งแยกให้เล็กลงกว่านั้นได้อีก แต่ในสมัยนั้นก็ยังไม่มีการทดลอง เพื่อพิสูจน์และสนับสนุนแนวความคิดดังกล่าว
ต่อมาวิทยาศาสตร์ได้เจริญก้าวหน้าขึ้น และนักวิทยาศาสตร์ก็พยายามทำการทดลองค้นหาคำตอบเกี่ยวกับเรื่องนี้ในรูปแบบต่าง ๆ ตลอดมา จนกระทั่งเกิดทฤษฎีอะตอมขึ้นมาในปี ค.ศ.1808 จากแนวความคิดของจอห์น ดาลตัน (John Dalton) ผู้เสนอสมมติฐานเกี่ยวกับแบบจำลองอะตอม และเป็นที่ยอมรับ และสนับสนุนจากนักวิทยาศาสตร์ในสมัยนั้น โดยทฤษฎีอะตอมของดาลตันได้กล่าวไว้ว่า
- สสารประกอบด้วยอะตอม ซึ่งเป็นหน่วยที่เล็กที่สุด แบ่งแยกต่อไปอีกไม่ได้ และไม่สามารถสร้างขึ้นหรือทำลายให้สูญหายไป
- ธาตุเดียวกันประกอบด้วยอะตอมชนิดเดียวกัน มีมวลและคุณสมบัติเหมือนกัน แต่จะแตกต่างจากธาตุอื่น
- สารประกอบเกิดจากการรวมตัวของอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปด้วยสัดส่วนที่คงที่
- อะตอมของธาตุแต่ละชนิดจะมีรูปร่างและน้ำหนักเฉพาะตัว
- น้ำหนักของธาตุที่รวมกัน ก็คือน้ำหนักของอะตอมทั้งหลายของธาตุที่รวมกัน
การค้นพบอิเล็กตรอน
การศึกษาการนำกระแสไฟฟ้าในแก๊สที่มีความดันต่ำได้รับ การพัฒนาอย่างต่อเนื่อง ในปี พ.ศ. 2398 ได้มีการสร้างเครื่องสูบสุญญากาศขึ้น และสิ่งประดิษฐ์นี้นำนักวิทยาศาสตร์ไปสู่การพบอิเล็กตรอนในที่สุด เมื่อมีการบรรจุแก๊สความดันต่ำเข้าไปในหลอดแล้วต่อขั้วไฟฟ้ากับแหล่งกำเนิดไฟฟ้าที่มีความต่างศักย์ไฟฟ้าสูง ดังรูป 1 พบว่าบริเวณผนังของหลอดจะเรืองแสงเป็นสีเขียวจางๆ
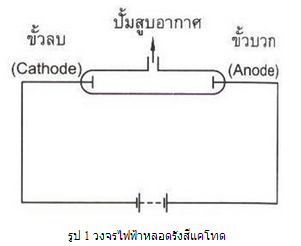
ต่อมาในปี พ.ศ. 2408 เซอร์ วิลเลียม ครูกส์ ทำการทดลองกับหลอดสุญญากาศเช่นกัน แต่ดัดงอหลอดเป็นมุมฉาก ดังรูป 2
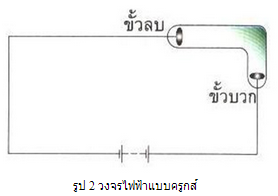
แล้วต่อขั้วไฟฟ้าของหลอดที่บรรจุแก๊สความดันต่ำนี้เข้ากับแหล่งกำเนิดไฟฟ้าที่มีความต่างศักย์ไฟฟ้าสูง พบว่าการเรืองแสงสีเขียวจะเกิดมากที่สุดตามบริเวณผนังหลอดด้านในที่อยู่ตรงข้ามขั้วแคโทดซึ่งเป็นขั้วลบ แสดงว่าการเรืองแสงดังกล่าวเกิดจากรังสีที่ออกมาจากขั้วแคโทด จึงเรียกรังสีนี้ว่า รังสีแคโทด
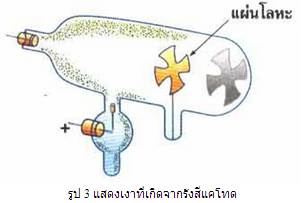
ในเวลาต่อมาได้มีการศึกษาธรรมชาติของรังสีแคโทด โดยใช้แผ่นโลหะบาง ๆ กั้นรังสีแคโทด ทำให้เกิดเงาของแผ่นโลหะปรากฏบนผนังหลอดดังรูป 3 และเมื่อให้รังสีแคโทดผ่านสนามแม่เหล็กและสนามไฟฟ้า พบว่า รังสีนี้มีการเปลี่ยนแปลงในบริเวณที่มีสนามทั้งสอง
การค้นพบอิเล็กตรอนโดยการทดลองของทอมสัน
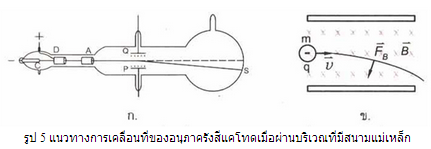
พ.ศ. 2440 เมื่อ เจ เจ ทอมสันทดลองใช้หลอดสุญญากาศลักษณะคล้ายหลอดและมีแผนภาพดังรูป 4 โดยมี C เป็นขั้วแคโทด A เป็นขั้วแอโนด P และ Q เป็นแผ่นโลหะขนาน
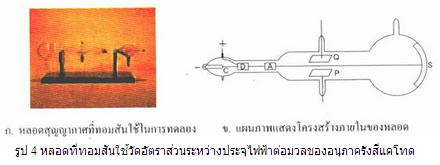
เมื่อต่อขั้วแคโทดและขั้วแอโนดกับแหล่งกำเนิดไฟฟ้าที่มีความต่างศักย์สูง รังสีแคโทดจะออกจากขั้วแคโทด C ไปยังขั้วแอโนด A ส่วนที่ผ่านช่องเล็ก ๆ ของทรงกระบอก A และ D เป็นลำของอนุภาคตรงไปกระทบสารเรืองแสงซึ่งฉาบไว้ที่ปลายอีกข้างหนึ่งของหลอด ทำให้เกิดจุดสว่างเล็ก ๆ S และเมื่อต่อแผ่นโลหะ P และ Q กับขั้วแบตเตอรี่ พบว่า จุดสว่าง S จะเลื่อนไปจากตำแหน่งเดิม
ข้อสังเกตที่ได้จากการทดลอง ทำให้ทอมสันสามารถสรุปได้ว่า รังสีแคโทดเป็นลำอนุภาคที่มีประจุไฟฟ้าลบ จึงเรียกอนุภาคดังกล่าวว่า อนุภาครังสีแคโทด
เมื่ออนุภาครังสีแคโทดเคลื่อนที่เข้าไปในบริเวณระหว่างแผ่นโลหะ P และ Q ขณะที่มีแต่สนามแม่เหล็ก สนามแม่เหล็กจะส่งแรงกระทำต่ออนุภาค ทำให้แนวการเคลื่อนที่เบนเป็นส่วนโค้งของวงกลม แต่เมื่ออนุภาครังสีแคโทดผ่านพ้นบริเวณที่มีสนามแม่เหล็ก มันจะเคลื่อนที่ในแนวเส้นตรงพุ่งไปกระทบฉากเรืองแสง ดังรูป 5ก


การหาประจุไฟฟ้าของอิเล็กตรอนโดยการทดลองของมิลลิแกน
จากการทดลองของทอมสัน ทำให้เราทราบอัตราส่วนระหว่าง ประจุไฟฟ้าต่อมวล (q/m) ของอิเล็กตรอน แต่ยังไม่ทราบประจุไฟฟ้าและขนาดมวลของอิเล็กตรอน จนกระทั่งนักฟิสิกส์ชื่อ โรเบิร์ต มิลลิแกน (Robert A. Millikan) โดยใช้เครื่องมือทดลองวัดค่าประจุไฟฟ้าของอิเล็กตรอนได้สำเร็จ
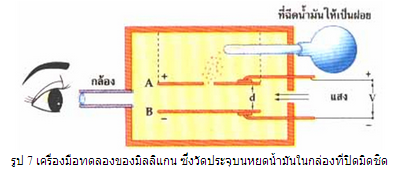
ส่วนบนของกล่องมีท่อฉีดน้ำมันเล็ก ๆ ฉีดน้ำมันให้เป็นหยดเล็กมาก (ฝอยน้ำมัน) และลอดช่องที่แผ่นโลหะ A ลงไปลอยอยู่ระหว่างแผ่นโลหะ AและB เราสามารถมองเห็นหยดน้ำมันเหล่านี้ โดยการมองผ่านกล้องจุลทรรศน์ ตอนแรกหยดน้ำมันมีสภาพเป็นกลางทางไฟฟ้า แต่เมื่อมันเคลื่อนที่เสียดสีกับอากาศหรือเกิดการเสียดสีกันเอง หรืออาจฉายด้วยรังสีเอกซ์จะทำให้หยดน้ำมันบางตัว เสียอิเล็กตรอน ทำให้ตัวเองมีสภาพเป็นบวกน้อย ๆ แต่บางตัวจะได้รับอิเล็กตรอนจากหยดน้ำมันอื่นทำให้มีสภาพเป็นลบน้อย ๆ เหมือนกัน
ถ้าหยดน้ำมันรับไอออนบวก แล้วจะมีประจุไฟฟ้าบวก
ถ้าหยดน้ำมันรับอิเล็กตรอน แล้วจะมีประจุไฟฟ้าลบ
ถ้าต่อ AB เข้ากับความต่างศักย์ค่าหนึ่ง จะทำให้เกิดสนามไฟฟ้า ขึ้นระหว่างแผ่นทั้งสอง โดยที่แผ่นบวกต่อกับขั้วบวก ส่วนแผ่นล่างต่อกับขั้วลบ และปรับความต่างศักย์ไฟฟ้า (สนามไฟฟ้า) ให้มีค่าอย่างพอเหมาะแล้ว จะมีหยดน้ำมันบางหยดลอยนิ่ง ๆ อยู่กับที่ เนื่องจากแรงเนื่องจากสนามไฟฟ้ามีค่าเท่ากับแรงโน้มถ่วงของโลกที่กระทำต่อหยดน้ำมัน

แบบจำลองอะตอมของทอมสัน
ทอมสันได้เสนอแบบจำลองอะตอมขึ้นใหม่ ดังนี้ "อะตอมมีลักษณะเป็นรูปทรงกลมประกอบด้วยอนุภาคที่มีประจุบวก และมีอิเล็กตรอนซึ่งมีประจุไฟฟ้าลบ อะตอมโดยปกติอยู่ในสภาพเป็นกลางทางไฟฟ้า ซึ่งทำให้ทั้งสองประจุนี้มีจำนวนเท่ากันและกระจายอยู่ทั่วไปอย่างสม่ำเสมอภายในอะตอม โดยมีการจัดเรียงที่ทำให้อะตอมมีสภาพเสถียรมากที่สุด" ดังรูป 8
แต่แบบจำลองอะตอมของทอมสันนี้ยังไม่สามารถอธิบายข้อสงสัยบางอย่างได้ เช่น ประจุไฟฟ้าบวก อยู่กันได้อย่างไรในอะตอม และไม่สามารถอธิบายคุณสมบัติอื่น ๆ ของอะตอม ตัวอย่างเช่น สเปกตรัมที่แผ่ออกมาจากธาตุ จึงมีนักวิทยาศาสตร์รุ่นต่อมาค้นคว้าและทดลองเพื่อหาข้อเท็จจริงต่อมา และปัจจุบันก็ได้ทราบว่าแบบจำลองที่ทอมสันเสนอไม่ถูกต้อง
การทดลองของรัทเทอร์ฟอร์ด
เออร์เนสต์ รัทเธอร์ฟอร์ด (Ernest Rutherford) ได้ทำการทดลองยิงอนุภาคแอลฟา ( นิวเคลียสของอะตอมฮีเลียม ) ไปที่แผ่นโลหะบาง ในปี พ.ศ.2449 และพบว่าอนุภาคนี้สามารถวิ่งผ่านได้เป็นจำนวนมาก แต่จะมีเพียงส่วนน้อยที่เป็นอนุภาคที่กระเจิง (การที่อนุภาคเบนจากแนวการเคลื่อนที่จากเดิมไปยังทิศทางที่ต่างไป) ไปจากแนวเดิมหรือสะท้อนกลับทางเดิม
จากการทดลองนี้ รัทเธอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมว่า " อะตอมมีลักษณะโปร่ง ประกอบด้วยประจุไฟฟ้าบวกที่รวมกันอยู่ที่ศูนย์กลางเรียกว่า นิวเคลียส ซึ่งถือว่าเป็นที่รวมของมวลเกือบทั้งหมดของอะตอม โดยมีอิเล็กตรอนเคลื่อนที่รอบ ๆ นิวเคลียสด้วยระยะห่างจากนิวเคลียสมาก เมื่อเทียบกับขนาดของนิวเคลียส และระหว่างนิวเคลียสกับอิเล็กตรอนเป็นที่ว่างเปล่า"
แต่แบบจำลองนี้ยังมีข้อกังขาที่ยังไม่สามารถหาคำตอบได้คือ
อิเล็กตรอนที่เคลื่อนที่โดยมีความเร่งจะแผ่คลื่นแม่เหล็กไฟฟ้าออกมา ทำให้พลังงานจลน์ลดลง ทำไมอิเล็กตรอนวิ่งวนรอบนิวเคลียสตามแบบจำลองของรัทเธอร์ฟอร์ด จึงไม่สูญเสียพลังงาน และไปรวมอยู่ที่นิวเคลียส
อะตอมที่มีอิเล็กตรอนมากกว่าหนึ่งตัว เมื่อวิ่งวนรอบนิวเคลียสจะจัดการเรียงตัวอย่างไร
ประจุบวกที่รวมกันอยู่ในนิวเคลียส จะอยู่กันได้อย่างไร ทั้ง ๆ ที่มีแรงผลักกัน
การทดลองด้านสเปกตรัม
1. สเปกตรัมจากอะตอมของแก๊ส
ถ้าใช้เกรตติงส่องดูแก๊สร้อนในหลอดบรรจุแก๊สชนิดต่าง ๆ จะเห็นว่า สเปกตรัมของแก๊สร้อนมีลักษณะเป็นเส้น ๆ แยกจากกันมิได้เรียงกันอย่างต่อเนื่อง ดังรูป 9

ขณะเดียวกันจะเห็นสเปกตรัมเส้นสว่างของแก๊สแต่ละชนิดว่ามีชุดสเปกตรัมเส้นสว่างแตกต่างกันด้วย ซึ่งสเปกตรัมเหล่านี้แสดงสมบัติเฉพาะตัวของธาตุแต่ละชนิด
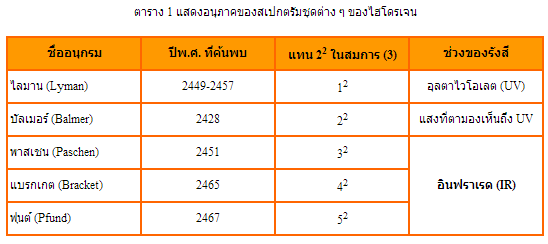
ถ้าวิเคราะห์สเปกตรัมของไฮโดรเจน จะเห็นเส้นสว่างที่มีความยาวคลื่นเรียงกันเป็นกลุ่มอย่างมีระเบียบ ซึ่งเรียกว่า อนุกรม ในปีพ.ศ. 2428 บัลเมอร์ สามารถหาสูตรที่คำนวณหาความยาวคลื่นของสเปกตรัมเส้นสว่างต่าง ๆ ของอะตอมไฮโดรเจนในช่วงที่ตาเปล่ามองเห็นได้ ซึ่งมีทั้งหมด 4 เส้น โดยใช้สมการ

2. การแผ่รังสีของวัตถุดำ
วัตถุดำ (Black Body) คือ ระบบในอุดมคติที่ดูดกลืนรังสี (คลื่นแม่เหล็กไฟฟ้า) ทั้งหมดที่ตกกระทบ ระบบที่สามารถประมาณได้ว่าเป็นวัตถุดำ เช่น ทรงกลมกลวงที่แสงผ่านเข้าไปแล้วกลับออกมาไม่ได้ วัตถุดำนอกจากจะดูดกลืนรังสีได้ดีแล้ว ยังแผ่รังสีได้ดีมากด้วย โดยจะแผ่คลื่นแม่เหล็กไฟฟ้าในช่วงความถี่ของรังสีอินฟราเรด (รังสีความร้อน)

ปรากฎการณ์โฟโตอิเล็กทริก
ปรากฏการณ์โฟโตอิเล็กตริก เป็นที่รู้จักกันมาก่อนยุคสมัยทฤษฎีควอนตัม แต่ไม่มีใครสามารถใช้ทฤษฎีคลาสสิกอธิบายผลการทดลองได้ จากการทดลอง เฮิร์ตซ์เป็นผู้ค้นพบว่า เมื่อแสงตกกระทบผิวโลหะอาจทำให้ประจุไฟฟ้าหลุดจากผิวโลหะได้ ปรากฎการณ์นี้เรียกว่า ปรากฎการณ์โฟโตอิเล็กทริก (Photoelectric effect)
ต่อมาทอมสันได้วัดค่าอัตราส่วนระหว่างประจุไฟฟ้าต่อมวลของอนุภาคที่ หลุดออกมาจากโลหะนั้น และพบว่ามีค่าเดียวกับอิเล็กตรอนที่หลุดออกมาจากแคโทด จึงเชื่อว่าอนุภาคนั้นเป็นอิเล็กตรอน และเรียกอิเล็กตรอนนั้นว่า โฟโตอิเล็กตรอน
การทดลองเรื่องปรากฎการณ์โฟโตอิเล็กทริก มีอุปกรณ์สำหรับทดลองดังรูปที่ 10 เมื่อฉายแสงตกกระทบที่แผ่นแคโทด C จะมีอิเล็กตรอนหลุดออกมาเคลื่อนที่ไปยังแผ่นแอโนด A ทำให้มีกระแสไฟฟ้าไหลผ่านในวจร
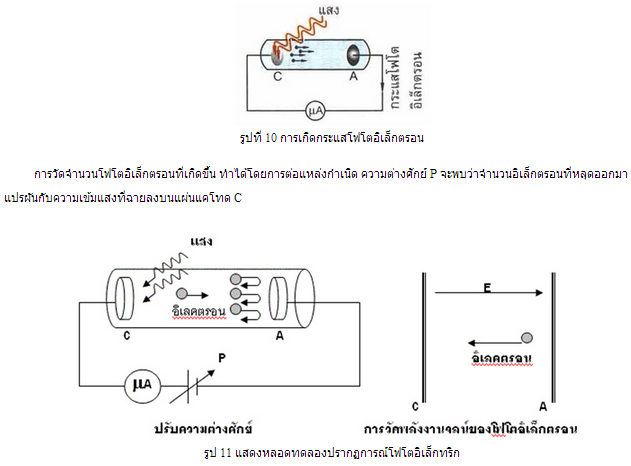
พลังงานจลน์สูงสุดของโฟโตอิเล็กตรอนสามารถหาได้ด้วยชุดการทดลองในหลอดสุญญากาศความดันต่ำดังรูป 11 เมื่อแสงกระทบโลหะขั้วแคโทด C จะมีอิเล็กตรอนหลุดแล้วเคลื่อนที่มาขั้วแอโนด A ทำให้มีกระแสไฟฟ้าในวงจร
จากนั้นใส่สนามไฟฟ้าสม่ำเสมอทิศเดียวกับทิศการเคลื่อนที่ของโฟโตอิเล็กตรอน ( ให้ขั้ว A มีศักย์เป็นลบเมื่อเทียบกับ C ) ซึ่งทำให้เกิดแรงไฟฟ้าในทิศตรงข้ามกับทิศการเคลื่อนที่ของโฟโตอิเล็กตรอน ทำให้อัตราเร็วลดลง จำนวนโฟโตอิเล็กตรอนที่วิ่งมาถึงขั้ว A จะลดลง โดยสังเกตได้จากกระแสลดลง และถ้าเพิ่มขนาดสนามไฟฟ้าจนกระทั่งโฟโตอิเล็กตรอนตัวที่มี พลังงานจลน์มากสุดเกือบจะถึงขั้ว A ( แต่ไม่ถึง ) ในกรณีนี้พลังงานจลน์สูงสุดของโฟโตอิเล็กตรอน จะเท่ากับผลต่างของพลังงานศักย์ไฟฟ้าระหว่างขั้ว A และ C พอดี ซึ่งขณะนี้จะไม่มีกระแสในวงจร

พลังงานของโฟตอน 1 ตัวที่สามารถทำให้เกิดปรากฏการณ์โฟโตอิเล็กทริกได้จะถูกถ่ายเทให้กับโลหะในรูปของพลังงานที่ใช้ทำลายการยึดอิเล็กตรอนไว้ เรียกว่าฟังก์ชั่นงาน (work function) และส่วนที่เหลือจะกลายเป็นพลังงานของโฟโตอิเล็กตรอนที่หลุดออกมา ตามกฎการอนุรักษณ์พลังงานกล่าวคือ

ทฤษฎีอะตอมของโบร์
โบร์ (Niel Bohr) นักฟิสิกส์ชาวเดนมาร์ค ได้เสนอแบบจำลองอะตอมไฮโดรเจน(อิเล็กตรอน 1 ตัว โปรตรอน 1 ตัว) โดยอาศัยทฤษฎีโฟตอนของไอน์สไตน์รวมกับโครงสร้างอะตอมของรัทเธอร์ฟอร์ด ปรากฏว่าโบร์สามารถอธิบายสเปกตรัมของอะตอมไฮโดรเจนได้อย่างดี ซึ่งในการอธิบายโบร์ได้ตั้งสมมติฐานดังนี้คือ




การทดลองของฟรังก์และเฮิรตซ์
ฟรังก์และเฮิรตซ์ได้ทำการทดลองที่สนับสนุนทฤษฎีอะตอมของโบร์ว่า อะตอมมีระดับพลังงานเป็นขั้น ๆ โดยใช้ชุดการทดลองที่ปรับพลังงานจลน์ของอิเล็กตรอนให้เคลื่อนที่ไปชนกับอะตอมของปรอท เขาสังเกตพบว่า ถ้าพลังงานจลน์ของอิเล็กตรอนน้อยกว่า 4.9 eV อิเล็กตรอนจะไม่สูญเสียพลังงานจลน์เลย และถ้าเพิ่มพลังงานจลน์จลน์ของอิเล็กตรอนไปถึงประมาณ 5 eV อิเล็กตรอนจะถ่ายเทพลังงานให้อะตอมของปรอทประมาณ 4.9 eV ถ้าเพิ่มพลังงานจลน์ขึ้นไปอีก การถ่ายเทพลังงานให้อะตอมของปรอทก็ยังเป็น 4.9 eV จึงสรุปได้ว่าอะตอมพลังงานของอะตอมปรอท มีลักษณะเป็นระดับชั้นที่ไม่ต่อเนื่อง และจากทฤษฏีของโบร์ เมื่ออิเล็กตรอนในอะตอมของปรอทลดระดับพลังงานมายังระดับพื้น จะต้องให้โฟตอนที่มีพลังงานเท่ากับ 4.9 eV ซึ่งจากการทดลองปรากฏว่าวัดความยาวคลื่นแสงที่เปล่งออกมาจากไอปรอทได้แสงมีความยาวคลื่น 253.5 นาโนเมตร ตรงกับพลังงานของแสงเท่ากับ 4.9 eV พอดี
การทดลองกับธาตุอื่นก็ให้ผลคล้ายคลึงกับกรณีปรอทคือ ในการชนระหว่างอิเล็กตรอนกับอะตอม อะตอมจะดูดกลืนพลังงานบางค่าเท่านั้น ซึ่งสนับสนุนความคิดของโบร์ที่ว่า ระดับพลังงานของอะตอมมีค่าไม่ต่อเนื่อง
รังสีเอกซ์
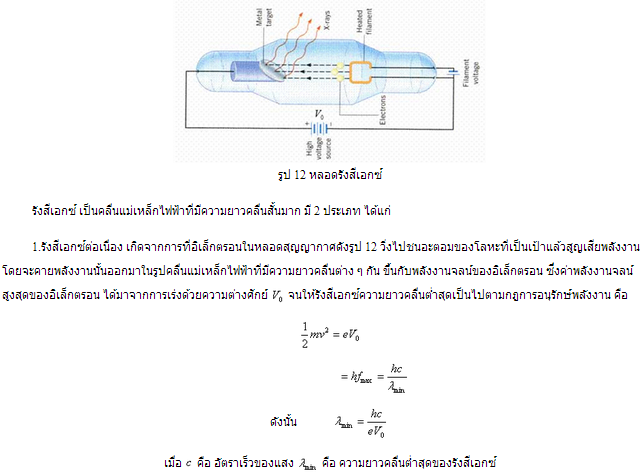
ในปี พ.ศ. 2438 (ค.ศ. 1895) วิลเฮล์ม เรินต์เกน ( Wihelm Roentgen ) นักฟิสิกส์ชาวเยอรมัน ค้นพบรังสีเอกซ์โดยบังเอิญขณะที่ทำการทดลองเกี่ยวกับรังสีแคโทด เขาสังเกตว่าเมื่ออิเล็กตรอนความเร็วสูงในหลอดแคโทดพุ่งชนสสาร จะเกิดรังสีที่มีอำนาจทะลุผ่านสูงเดินเป็นเส้นตรง และไม่เบี่ยงเบนโดยสนามไฟฟ้าและแม่เหล็ก รังสีนี้ทำให้ฟอสฟอเรสเซนต์สว่างเรืองรองขึ้น และทำให้เกิดภาพบนแผ่นฟิล์มถ่ายรูป ยิ่งอิเล็กตรอนเริ่มแรกมีความเร็วมาก รังสีที่เกิดขึ้นก็ยิ่งมีอำนาจทะลุทะลวงสูง และถ้าอิเล็กตรอนมีจำนวนยิ่งมากความเข้มของรังสีก็จะเพิ่มขึ้นไปด้วย เรินต์เกนให้ชื่อรังสีนี้ว่า รังสีเอกซ์

การเกิดรังสีเอกซ์ที่มีความยาวคลื่นเฉพาะค่ายืนยันความถูกต้องของทฤษฎีอะตอมของโบร์ที่ว่า อะตอมมีระดับพลังงานเป็นชั้น ๆ
ปัจจุบันมีการนำรังสีเอกซ์ไปใช้ประโยชน์ต่าง ๆ อย่างกว้างขวาง เช่น วงการแพทย์ ใช้รังสีเอกซ์ในการตรวจวินิจฉัยโรคที่เกิดในอวัยวะภายในร่างกาย การเอกซเรย์กระดูก ส่วนต่าง ๆ ของร่างกายของคนที่ได้รับอุบัติเหตุ ภาคอุตสาหกรรม ใช้รังสีเอกซ์ตรวจสอบข้อบกพร่องหรือรอยร้าวของโครงสร้างต่าง ๆ ตำรวจใช้รังสีเอกซ์ตรวจหาอาวุธปืน วัตถุระเบิดที่ซุกซ่อนในหีบห่อหรือกระเป๋าเดินทางตามด่านต่าง ๆ โดยไม่ต้องเปิดหีบห่อหรือกระเป๋า
ความไม่สมบูรณ์ของทฤษฎีอะตอมของโบร์
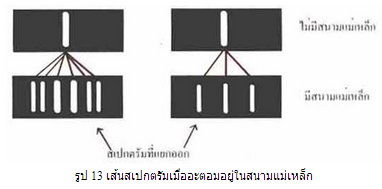
แม้ทฤษฎีอะตอมของโบร์สามารถอธิบายสเปกตรัมของอะตอมไฮโดรเจนได้ดีและทำให้ทราบถึงการจัดเรียงอิเล็กตรอนในอะตอมไฮโดรเจน แต่ก็ไม่สามารถคำนวณและอธิบายสเปกตรัมของอะตอมอื่น ๆ ที่มีอิเล็กตรอนหรือโปรตอนมากกว่า 1 ตัวได้ นอกจากนี้ยังมีการทดลองที่แสดงว่าอะตอมที่อยู่ในสนามแม่เหล็กจะให้สเปกตรัมที่เป็นชุดผิดปกติ คือสเปกตรัมเส้นหนึ่ง ๆ แยกออกเป็นหลายเส้นได้ ดังรูป
หากพิจารณาทฤษฎีอะตอมของโบร์ จะเห็นว่าโบร์ได้เอาความคิดฟิสิกส์ของนิวตันและคูลอมบ์ดั้งเดิมผสมกับฟิสิกส์แผนใหม่ที่ว่าด้วยควอนตัมของพลังงานของพลังค์ จะเห็นได้ว่าตอนแรกของทฤษฎีอะตอมของโบร์กล่าวถึงการโคจรของอิเล็กตรอนรอบนิวเคลียส ซึ่งถือว่าแรงสู่ศูนย์กลางที่กระทำต่อกับอิเล็กตรอนเกิดจาก แรงดึงดูดระหว่างประจุไฟฟ้าของอิเล็กตรอนกับนิวเคลียสซึ่งเป็นหลักของฟิสิกส์ดั้งเดิม แต่โบร์เสนอว่าอิเล็กตรอนที่เคลื่อนที่ด้วยความเร่งในวงโคจร ไม่จำเป็นต้องปลดปล่อยพลังงานและอิเล็กตรอนถูกจำกัดให้โคจรอยู่ในวงโคจรที่เป็นวงกลมบางวงเท่านั้น
จะเห็นได้ว่า ทฤษฎีอะตอมของโบร์มีบางส่วนที่ยอมรับและบางส่วนที่ปฏิเสธ ทฤษฎีฟิสิกส์ดั้งเดิม ดังนั้นทฤษฎีอะตอมของโบร์จึงไม่สามารถอธิบายปรากฏการณ์ของอะตอมได้อย่างสมบูรณ์ จึงน่าจะมีทฤษฎีใหม่ที่สามารถอธิบายปรากฏการณ์ต่าง ๆ ได้สมบูรณ์ยิ่งขึ้น ซึ่งนำไปสู่การพัฒนาวิชากลศาสตร์ควอนตัม แนวคิดสำคัญของทฤษฎีทางกลศาสตร์ควอนตัม คือ สมบัติทวิภาพของสสารในรูปของคลื่นและอนุภาค
ทวิภาพของคลื่นและอนุภาค
1. ปรากฏการณ์คอมป์ตัน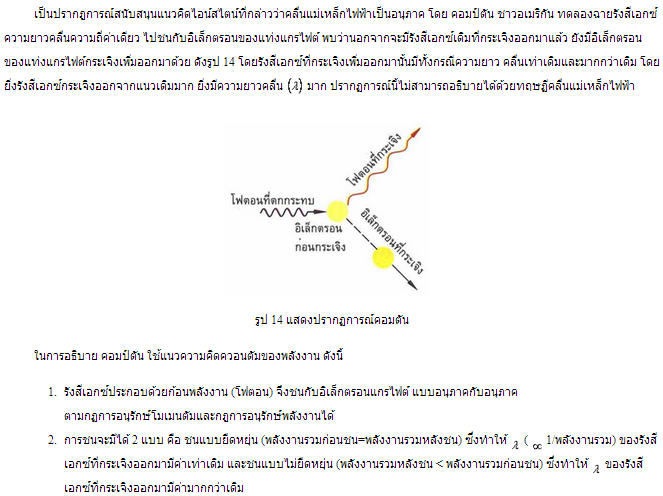
คอมป์ตัน ใช้แนวคิดดังกล่าวสร้างสมการเพื่ออธิบายปรากฏการณ์นี้ ซึ่งพบว่าสมการดังกล่าวสามารถอธิบายและทำนายปรากฏการณ์ได้ถูกต้อง คอมป์ตันจึงสรุปว่า เมื่อแสงและรังสีเอกซ์ ซึ่งเป็นคลื่นแม่เหล็กไฟฟ้าประพฤติตัวเป็นอนุภาคได้ คลื่นแม่เหล็กไฟฟ้าสเปกตรัมอื่นๆ เช่น คลื่นวิทยุ รังสีอินฟาเรด รังสีอัลตราไวโอเลต ไมโครเวฟ และรังสีแกมมา ก็สามารถประพฤติตัวเป็นอนุภาคได้เช่นกัน
2. สมมติฐานของเดอ บรอยล์
ในปี พ.ศ. 2467 เดอบรอยล์ ( Louis de Broglie) ชาวฝรั่งเศส เสนอแนวคิดว่า เนื่องจากสิ่งต่าง ๆ ประกอบด้วยสสารและพลังงาน ดังนั้น “ถ้าแสงหรือคลื่นแม่เหล็กไฟฟ้า ( เป็นพลังงานรูปหนึ่ง ) สามารถแสดงสมบัติได้ทั้งคลื่นและอนุภาค สสาร ( ซึ่งประกอบด้วยอนุภาค ) ก็ควรแสดงสมบัติได้ทั้งคลื่นและอนุภาค” เช่นกัน
จากทฤษฏีสัมพัทธภาพของไอน์สไตน์

เรียกความยาวคลื่นอนุภาคหรือความยาวคลื่นสสารนี้ว่า “ความยาวคลื่นเดอบรอยล์” ( de Broglie wavelength)
หลังจากที่เดอ บรอยล์ เสนอความคิดของเขาแล้ว มีนักวิทยาศาสตร์อีกหลายท่านได้พยายามทดสอบความถูกต้องของสมมติฐานดังกล่าว โดยคิดว่าถ้าอนุภาคมีสมบัติของคลื่น อนุภาคก็น่าจะแสดงสมบัติการแทรกสอดและการเลี้ยวเบนได้เช่นเดียวกับคลื่นทั่วไป อนุภาคที่ใช้ในการศึกษาครั้งแรกก็คือ อิเล็กตรอน
ในปีพศ. 2466 เดวิสสันและเจอร์เมอร์ จึงทดลองยิงอิเล็กตรอนไปกระทบผลึกของนิกเกิล ปรากฎว่าอิเล็กตรอนแสดงสมบัติการแทรกสอดและการเลี้ยวเบนของคลื่น ซึ่งเมื่อผ่านอะตอมในผลึกซึ่งเรียงตัวกันเป็นระเบียบ จะให้ผลการทดลองในลักษณะเดียวกับกรณีรังสีเอกซ์
เมื่อให้ลำอิเล็กตรอนผ่านตัวกำบังขอบตรงที่ขวางทางเดินของลำอิเล็กตรอน อิเล็กตรอนจะแสดงสมบัติการเลี้ยวเบน แล้วไปแทรกสอดบนแผ่นฟิล์ม ดังรูป 15

ปีต่อมา จี.พี.ทอมสัน ได้ทดลองยิงอิเล็กตรอนความเร็วสูง หรือรังสีแคโทดผ่านแผ่นโลหะบาง ๆ เช่น อะลูมิเนียม เงิน และทองคำ ปรากฎว่าอิเล็กตรอนเลี้ยวเบนผ่านผลึกโลหะไปแทรกสอดบนฟิล์มได้ภาพในลักษณะเดียว กับที่ทดลองโดยใช้รังสีเอกซ์ ดังรูป 16 จึงเห็นได้ว่า คลื่นแสดงสมบัติของอนุภาคได้ และอนุภาคก็แสดงสมบัติของคลื่นได้ สมบัติดังกล่าวนี้เรียกว่า ทวิภาพของคลื่นและอนุภาค

กลศาสตร์ควอนตัม
1. หลักความไม่แน่นอน
กลศาสตร์ควอนตัมมี 2 แนวคือ แนวของ ชเรอดิงเงอร์ นักฟิสิกส์ชาวออสเตรีย ซึ่งใช้แนวคิดมาจากสมมติฐานของ เดอ บรอยล์ แนวนี้นิยมเรียก “กลศาสตร์คลื่น” ส่วนแนวที่ 2 เป็นของ ไฮเซนเบิร์ก ชาวเยอรมัน ใช้แนวคิดทางคณิตศาสตร์แมตทริกซ์ ซึ่งค่อนข้างเข้าใจยาก ต่อมามีผู้พิสูจน์ว่าทั้งสองแนวให้ผลเช่นเดียวกัน ในที่นี้จะกล่าวเฉพาะแนวของชเรอดิงเงอร์ ในแนวกว้าง ๆ ดังนี้
เมื่อจะศึกษาธรรมชาติของอิเล็กตรอนในอะตอม ให้นึกภาพอิเล็กตรอนประพฤติตัวเป็นกลุ่มคลื่น โดยความเร็วของกลุ่มคลื่นเท่ากับความเร็วของอิเล็กตรอน จากนั้นให้สร้างสมการกลุ่มคลื่นของอิเล็กตรอนขึ้นมา แล้วนำสมการนี้ไปศึกษา จะสามารถรู้ธรรมชาติของอิเล็กตรอนขณะอยู่ในอะตอมได้
ประเด็นหนึ่งที่สำคัญของกลศาสตร์ควอนตัม คือ การที่คิดว่าอิเล็กตรอนประพฤติตัวเป็นคลื่น เราจึงไม่สามารถคำนวณค่าต่าง ๆ ของอิเล็กตรอนได้แน่นอน ซึ่งเป็นจริงตามธรรมชาติของคลื่น ค่าที่เราคำนวณได้จากกลศาสตร์ควอนตัมจึงเป็นเพียงโอกาสที่จะเป็นไปได้ หรือ ความน่าจะเป็น ของปริมาณนั้น ๆ เช่น ความน่าจะเป็นในการพบอิเล็กตรอนที่อยู่ในรูปกลุ่มคลื่น เป็นต้น เพราะถ้าคิดว่าอิเล็กตรอนเป็นคลื่น ขนาดและตำแหน่งของคลื่นย่อมกระจายอยู่ในอาณาเขตอันหนึ่ง และไม่สามารถบอกได้ชัดเจนว่าอยู่ ณ ที่ใด

2. โครงสร้างอะตอมตามแนวคิดกลศาสตร์ควอนตัม
ตามหลักความไม่แน่นอนของไฮเซนเบิร์ก เราไม่สามารถระบุได้ว่าอิเล็กตรอนที่เคลื่อนที่รอบนิวเคลียสของอะตอมนั้นอยู่ที่ตำแหน่งใดได้แน่นอน หรือเคลื่อนที่ในลักษณะใดได้อีกต่อไป เราบอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอน ณ ตำแหน่งต่าง ๆ ว่าเป็นเท่าใดเท่านั้น พฤติกรรมต่าง ๆ ของอิเล็กตรอนในอะตอมจะหาได้จากการแก้สมการคลื่นของชเรอดิงเงอร์ ซึ่งให้คำตอบที่สมบูรณ์กว่าทฤษฎีอะตอมของโบร์ ทำให้มีการจินตนาการภาพโอกาสการค้นพบอิเล็กตรอนรอบอะตอม คล้ายกลุ่มหมอกห่อหุ้มนิวเคลียสอยู่ หากโอกาสที่จะพบอิเล็กตรอน ณ ตำแหน่งใดมากที่นั้นจะมีกลุ่มหมอกหนาแน่น(ความน่าจะเป็นสูง)
ภาพกลุ่มหมอกเปรียบเทียบกับโอกาสที่จะพบอิเล็กตรอนรอบ ๆ อะตอมเป็นไปได้หลายรูปแบบ อะตอมไฮโดรเจนซึ่งอิเล็กตรอนมีระดับพลังงานต่ำสุด กลุ่มหมอกจะเป็นกลุ่มทรงกลม กล่าวคือ โอกาสที่จะพบอิเล็กตรอน ณ ตำแหน่งที่ห่างจากนิวเคลียสในทุกทิศทางเป็นระยะทางเท่ากัน จะเท่ากันหมด กรณีที่อิเล็กตรอนมีระดับพลังงานสูงขึ้น กลุ่มหมอกจะจัดตัวแตกต่างจากรูปทรงกลม ดังรูป 17ฃ




