แบบจำลองอะตอม
ประมาณ 500 ปี ก่อนคริตศักราช นักปราชญ์กรีกชื่อ ดิโมเครตุส(Democritus) และลาซิปปุส(Leucippus) เชื่อว่าเมื่อย่อยสารลงเรื่อย ๆ จะได้ซึ่งไม่สามารถทำให้เล็กลงกว่าเดิมได้อีก และเรียกอนุภาคที่เล็กที่สุดว่า “อะตอม” (atom มาจากภาษากรีกคำว่า atomos แปลว่าแบ่งแยกอีกไม่ได้) และสิ่งที่เล็กที่สุดนี้ของแต่ละธาตุต่างกันจึงทำให้สมบัติต่าง ๆ ของแต่ละธาตุแตกต่างกันด้วย แต่ความเชื่อนี้ไม่ได้รับการยอมรับจากนักปราชญ์ที่มีชื่อเสียงในสมัยนั้น (Plato และ Aristotle)
แบบจำลองอะตอมเป็นมโนภาพที่นักวิทยาศาสตร์สร้างขึ้นโดยอาศัยข้อมูลที่ได้จากการทดลอง เพื่ออธิบายสมมติฐานที่ตั้งขึ้น แบบจำลองอะตอมที่สร้างขึ้นมานั้นสามารถปรับปรุงและพัฒนาเมื่อพบข้อมูลใหม่ที่แบบจำลองเดิมไม่สามารถอธิบายได้
แบบจำลองอะตอมของดอลตัน
ในปี ค.ศ.1808 John Dalton ครูสอนวิทยาศาสตร์ คณิตศาสตร์ และนักปรัชญา ชาวอังกฤษ ได้เสนอแนวคิดเกี่ยวกับอะตอมที่เรียกว่าทฤษฎีอะตอม มีใจความสำคัญว่า
- สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุด ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก เรียกว่า atom
- อะตอมของธาตุชนิดเดียวกัน ย่อมมีสมบัติเหมือนกันทุกประการ(เช่นมีมวลเท่ากัน) และมีสมบัติแตกต่างจากอะตอมของธาตุอื่น
- ไม่สามารถทำให้อะตอมสูญหายหรือเกิดใหม่ได้ (กฎทรงมวล Law of conservation mass)
- สารประกอบเกิดจากการรวมตัวทางเคมีระหว่างอะตอมของตั้งแต่สองชนิดขึ้นไป และจำนวนอะตอมของธาตุที่รวมตัวกันจะเป็นอัตราส่วนตัวเลขลงตัวน้อย ๆ (กฎสัดส่วนคงที่ Law of multipleproperties)
Dolton เสนอมโนภาพของแบบจำลองอะตอมว่า อะตอมมีลักษณะทรงกลมตัน มีขนาดเล็กมาก และไม่สามารถแบ่งแยกได้อีก

ภาพที่ 1 แสดงแบบจำลองอะตอมของ Dolton
ที่มา : http://thehistoryoftheatom.weebly.com/john-dalton.html
เมื่อนักวิทยาศาสตร์ได้ทำการทดลองค้นคว้าได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น พบว่าแบบจำลองอะตอมของ Dolton ไม่สามารถอธิบายได้ เช่น
- ทำไมอะตอมของธาตุต่างกันจึงมีมวลต่างกัน
- อะตอมของธาตุชนิดเดียวกันอาจมีสมบัติต่างกันได้ เช่น ไฮโดรเจนมี 3 ไอโซโทป 1H, 2H และ 3H เป็นธาตุชนิดเดียวกันแต่มีมวลต่างกัน
- ทำไมธาตุจึงมีความว่องไวในการเกิดปฏิกิริยาต่างกัน
- ทำไมธาตุหนึ่ง ๆ ทำปฏิกิริยาได้เฉพาะบางธาตุ
- อะตอมทำให้เกิดขึ้นใหม่หรือเปลี่ยนไปเป็นอะตอมของธาตุอื่นได้ หรือสามารถสังเคราะห์อะตอมของธาตุใหม่ได้โดยอาศัยปฏิกิริยานิวเคลียร์
ด้วยสาเหตุดังกล่าวจึงทำให้มีผู้ศึกษาค้นคว้าแบบจำลองอะตอมใหม่เพื่ออธิบายสิ่งที่เกิดขึ้น
แบบจำลองอะตอมของทอมสัน
Sir Joseph John Thomson นักวิทยาศาสตร์ชาวอังกฤษได้รวบรวมนำการศึกษาด้านต่าง ๆ ของผู้สนใจค้นคว้าในแต่ละสาขามารวมกันเป็นแบบจำลองอะตอมใหม่ เพื่ออธิบายปรากฏการณ์ที่แบบจำลองอะตอมของดอลตันไม่สามารถอธิบายได้ การทดลองที่สำคัญ คือ
- หลอดรังสีแคโทดของ William Crookers
- หลอดรังสีแคโทดของ Sir Joseph John Thomson
- การหาค่าประจุของอิเล็กตรอนโดยวิธีเม็ดน้ำมันของ Robert Andrews Millikan
- หลอดรังสีแคโทดของ Eugen Goldstrin
- หลอดรังสีแคโทดของ William Crookers
จากปรากฏการณ์ธรรมชาติที่แสดงให้เห็นว่าแก๊สนำไฟฟ้าได้ คือ ปรากฏการณ์ฟ้าร้อง ฟ้าผ่า นักวิทยาศาสตร์จึงได้ทำการทดลองเพื่ออธิบายการนำไฟฟ้าของแก๊สพบว่า ที่ความดัน 1 บรรยากาศ (1 atm) อากาศจะไม่นำไฟฟ้า แต่ถ้าลดความดันลง และเพิ่มความต่างศักย์ระหว่างขั้วมาก ๆ แก๊สจะนำไฟฟ้าได้ดี
William Crookers ได้ประดิษฐ์อุปกรณ์เพื่อจำลองปรากฏการณ์ฟ้าร้อง ฟ้าผ่า ประกอบด้วยหลอดแก้วที่บรรจุแก๊สความดันต่ำ มีขั้วไฟฟ้าเป็นแผ่นโลหะ (Electrode) 2 ขั้ว ต่อเข้ากับเครื่องกำเนิดไฟฟ้าที่มีความต่างศักย์สูง (10,000 – 20,000 volte) แผ่นโลหะด้านไฟฟ้าลบเรียกว่า ขั้ว cathode แผ่นโลหะด้านไฟฟ้าบวกเรียกว่า ขั้ว anode และยังได้วางฉากเรืองแสง (ZnS ซิงค์ซัลไฟด์) ขนานไปตามแนวยาวของหลอด
จากการทดลองของ Crookers พบว่า
- ที่ความดัน 1 บรรยากาศ ไม่เห็นการเปลี่ยนแปลงใด ๆ
- เมื่อลดความดันลง แก๊สภายในหลอดแก้วจะเรืองแสง
- เมื่อลดความดันลงมาก ๆ บริเวณ anode จะเรืองแสงมาก
- เมื่อนำ หมุนได้ไปไว้ระหว่างขั้ว anode และ cathode ใบพัดจะหมุนได้
- เมื่อนำฉากเรืองแสง ZnS ไว้ระหว่างขั้ว anode และ cathode ฉากด้านที่หันไปทางขั้ว cathode เรืองแสงและเกิดเงา
เพราะฉะนั้นจึงสามารถกล่าวได้ว่ามีรังสีชนิดหนึ่งพุ่งออกมาจากขั้ว cathode เป็นเส้นตรงมายังขั้ว anode เรียกรังสีนี้ว่า cathode ray cathode ray ประกอบด้วยอนุภาคไฟฟ้าที่มีประจุลบและมีมวลเพราะสามารถทำให้ใบพัดของกังหันหมุนได้
- หลอดรังสีแคโทดของ Sir Joseph John Thomson
ค.ศ. 1897 (พ.ศ. 2440) Sir Joseph John Thomson นักวิทยาศาสตร์ชาวอังกฤษ ได้ดัดแปลงหลอดรังสีแคโทด พบว่าเมื่อลดความดันลงจนเกือบเป็นสูญญากาศ จะมีจุดสว่างบนฉากเรืองแสง Thomson จึงตั้งสมมุติฐานว่า รังสี cathode เป็นอนุภาคที่มีประจุ ดังนั้นอนุภาคควรจะเบี่ยงเบนในสนามแม่เหล็กและสนามไฟฟ้า
เมื่อนำสนามไฟฟ้าภายนอกมาล่อ จุดสว่างบนฉากเรืองแสงจะเบี่ยงเบนเข้าหาขั้วบวกเสมอ เพราะฉะนั้น Thomson จึงสรุปว่า รังสี cathode ประกอบด้วยอนุภาคลบที่เคลื่อนที่ออกจากขั้ว cathode ในลักษณะรังสี
Thomson ได้ทำการทดลองต่อโดย
- เปลี่ยนแก๊สภายในหลอดรังสี cathode โดยโลหะที่ทำขั้วยังคงเดิม พบว่าได้ผลการทดลองเช่นเดิม
- เปลี่ยนโลหะที่ใช้ทำขั้วเป็นโลหะชนิดต่าง ๆ แต่ใช้แก๊สชนิดเดิม พบว่าได้ผลการทดลองเช่นเดิม
สรุปได้ว่าไม่ว่าจะบรรจุแก๊สชนิดใดหรือใช้โลหะชนิดใดมาทำขั้ว หลอดรังสี cathode จะให้รังสี cathode ที่เป็นอนุภาคลบเหมือนกัน
Thomson ได้ทำการทดลองต่อโดยนำหลอดรังสี cathode วางไว้ในสนามแม่เหล็กและสนามไฟฟ้าที่ตั้งฉากกั้น จากนั้นค่อย ๆ เพิ่มอำนาจสนามแม่เหล็กจน รังสี cathode ไม่มีการเบี่ยงเบนแสดงว่าความแรงของสนามไฟฟ้ามีค่าเท่ากับความแรงสนามแม่เหล็ก Thomson อาศัยค่าความแรงของสนามแม่เหล็กและความแรงของสนามไฟฟ้าที่กระทำต่ออนุภาคลบในรังสี cathode หาอัตราส่วนประจุต่อมวล (e/m) ของอนุภาคได้ e/m = 1.759 x 108 คูลอมบ์ต่อกรัม
Thomson จึงสรุปว่า อนุภาคไฟฟ้าที่มีประจุลบเป็นองค์ประกอบของอะตอมของธาตุทุกชนิด และเรียกชื่ออนุภาคนี้ว่า อิเล็กตรอน (Electron)
- การหาค่าประจุของอิเล็กตรอนโดยวิธีเม็ดน้ำมันของ Robert Andrews Millikan
ในปี ค.ศ.1909 (พ.ศ.2452) Robert Andrews Millikan นักวิทยาศาสตร์ชาวอเมริกัน ได้ทดลองหาค่าประจุของอิเล็กตรอนโดยวิธีเม็ดน้ำมัน (Oil-drop experiment) เมื่อพ่นละอองเม็ดน้ำมันเข้าไปหยดน้ำมันจะเคลื่อนที่จากบนลงล่างตามแรงดึงดูดของโลกแต่เมื่อฉาย X-ray จะทำให้อากาศภาย (ในแตกตัวเป็นอนุภาคบวกและลบไปเกาะบนหยดน้ำมันที่มีประจุลบเท่านั้น) ดังนั้นเมื่อใส่สนามไฟฟ้าเข้าไปหยดน้ำมันที่มีประจุลบเกาะอยู่จะเคลื่อนที่ลงมาช้าลงเพราะขั้วบวกที่อยู่ด้านบนดึงดูดเอาไว้จากนั้นปรับสนามไฟฟ้าจนกระทั้งแรงดึงดูดจากสนามไฟฟ้า(ด้านบน)กับแรงดึงดูดของโลกมีค่าเท่ากันหยดน้ำมันจะลอยนิ่งนั้นคือ
จากสมการ F1 = mg (1)
เมื่อถ้า m = มวลของหยดน้ำมัน
g = แรงดึงดูดของโลก
F1 = แรงดึงดูดของโลกที่กระทำต่อหยดน้ำมัน
และจากสมการ F2 = Eq (2)
เมื่อ q = ประจุบนหยดน้ำมัน
E = สนามไฟฟ้า
F2 = แรงที่สนามไฟฟ้ากระทำต่อประจุบนหยดน้ำมัน
เมื่อหยดน้ำมันลอยนิ่ง สมการที่ 1 = สมการที่ 2
F1 = F2
mg = Eq
q = (mg) /E
ค่า m และ E หาได้จากเครื่องมือที่ใช้ Milikan พบว่าประจุบนเม็ดน้ำมันที่น้อยสุดว่ามีค่าเป็นเลขจำนวนเต็มคูณด้วย 1.602 x 10-19 คูลอมบ์ (coulomb) Milikan จึงนับค่าประจุไฟฟ้าของเม็ดน้ำมันที่น้อยสุดว่ามีค่า = 1 x 1.602 x 10-19 คูลอมบ์ว่าเป็นประจุของเม็ดน้ำมันเมื่อมีอิเล็กตรอน 1 ตัว เพราะฉะนั้นประจุของอิเล็กตรอนมีค่า = 1 x 1.602 x 10-19 coulomb
การหาค่ามวลของอิเล็กตรอน
เมื่อทราบค่าประจุไฟฟ้าของอิเล็กตรอนก็สามารถนำมาแทนค่าในสมการของ Thomson
สมการของ Thomson e/m = 1.759 x108 coulomb / g
แทนค่า e จาก Milikan e = 1.602 x 10-19 coulomb
จะได้มวลของ electron m = 9.11 xx10-28 g
- หลอดรังสีแคโทดของ Eugen Goldstein (การค้นพบ Proton)
การที่อะตอมทุกชนิดมี electron เป็นองค์ประกอบแต่อะตอมมีคุณสมบัติเป็นกลางทางไฟฟ้าทำให้นักวิทยาศาสตร์เชื่อว่าจะต้องมีอนุภาคที่มีประจุไฟฟ้าเป็นบวกเป็นองค์ประกอบในปี ค.ศ. 1889 (พ.ศ. /2429) Eugen Goldstrin นักฟิสิกส์ชาวเยอรมันได้ดัดแปลงหลอดรังสี cathode ดังรูป
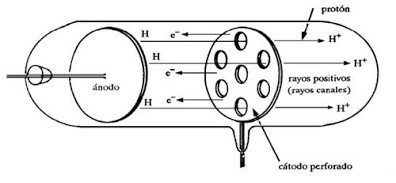
ภาพที่ 2 แสดงหลอดรังสีแคโทดของ Eugen Goldstrin
ที่มา : https://sites.google.com/site/631laintimidaddelamateria/descubrimiento-de-las-particulas-subatomicas
โดยเลื่อน cathode และ anode ที่เจาะรูมาไว้เกือบตรงกลางและมีฉากเรื่องแสงอยู่ที่ปลายทั้งสองข้างเมื่อผ่านกระแสไฟฟ้าศักดิ์สูงเข้าไปปรากฏว่ามีแสงสว่างเกิดขึ้นบนฉากเรื่องแสงทั้งสองตรงกับตำแหน่งที่เจาะรูไว้แสดงว่ามีรังสีจากขั้ว anode ไปขั้ว cathode ผ่านรูตรงกลางที่เจาะไว้กระทบกับฉากเรืองแสงรังสีนี้จะเกิดขึ้นพร้อมๆกับ cathode ray เรียกรังสีที่พบใหม่ว่า positive ray หรือ anode ray หรือ canal ray
เมื่อทดลองหลายครั้งโดยเปลี่ยนชนิดของ gas ในหลอดพบว่าอนุภาคที่มีประจุบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่คงที่และจะขึ้นกับชนิดของ gas ที่บรรจุในหลอดแต่ถ้าใช้ gas ชนิดเดิมแล้วเปลี่ยนชนิดขั้วโลหะที่ทำ anode พบว่าอัตราส่วนต่อประจุต่อมวลมีค่าคงเดิม
Goldstien ได้สรุปผลการทดลองว่าอัตราส่วนประจุต่อมวลขึ้นอยู่กับชนิดของ gas (gas ต่างชนิดกันจะมีผลมวลต่างกัน)
เมื่อใช้ Hydrogen gas จะได้อนุภาค(H+ (g) มีค่าประจุต่อมวลมากที่สุดโดยที่อนุภาคบวกนี้มีค่าประจุเท่ากับ electron (ทำให้มวลของอนุภาคบวกดังกล่าวมีค่าต่ำสุด) จึงเรียกอนุภาคบวกหรือไอออนบวกจาก Hydogen gas ว่า Proton ซึ่งมาจากภาษากรีกว่า Proteinos ซึ่งมีความหมายเป็นสิ่งสำคัญสิ่งแรก(fist importance)
Thomson เสนอแบบจำลองอะตอมว่า “อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตรอนที่มีประจุบวกและอิเล็กตรอนที่มีประจุลบกระจายอยู่ทั่วไปอย่างสม่ำเสมออะตอมในสภาวะเป็นกลางจะมีประจุบวกเท่ากับประจุลบนอก” จากนี้ยังหาค่า e / m ของ hydrogas หรือ Proton ได้เท่ากับ 9.58 x 104 coulomb/ g แทนค่า e = 1.6 x 10-19 จะได้ค่ามวลของ proton = 1.66 x 10-24 g เมื่อเปรียบเทียบมวลของ proton กับมวลของ electron พบว่ามวลของ proton จะมีค่ามากกว่ามวลของ electron ประมาณ 1800 เท่า
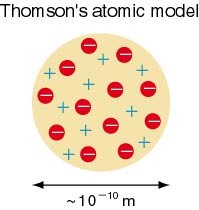
ภาพที่ 3 แสดงแบบจำลองอะตอมของทอมสัน (Thomson)
ที่มา http://ne.phys.kyushu-u.ac.jp/seminar/MicroWorld1_E/Part2_E/P24_E/Thomson_model_E.htm
กลับไปที่เนื้อหา
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
หลังจากนักวิทยาศาสตร์ชาวฝรั่งเศส Henri Becquerel ได้พบสารกัมมันตรังสีและเรินต์เกน (W.K.Rontgen) ค้นพบ X-ray Lord Emert Ruthetford นักวิทยาศาสตร์ชาวนิวซีแลนด์ได้ทำการการศึกษาธรรมชาติของรังสีที่เกิดจากสารกัมมันตรังสีพบว่ามี 3 ชนิดคือ
- รังสีเอลฟา (a – ray) ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าเป็นบวก (+2) เป็นนิ้วเคลียสของอะตอมของธาตุฮีเลียมคือประกอบด้วย proton 2 ตัว และ Neutron 2 ตัว อำนาจผ่านทะลุวัตถุได้น้อยมากถูกกั้นโดยกระดาษเพียงแผ่นเดียวหรือสองแผ่น
- รังสีเบต้า (B-ray) ประกอบด้วยอิเล็กตรอนที่มีพลังงานสูงมีอำนาจการผ่านทะลุสูงกว่ารังสีแอลฟาถูกกั้นโดยใช้แผ่นโลหะบางๆ
- รังสีแกมมา (Y-ray) แสดงสมบัติเป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมากคล้าย X-ray รังสีแกมมาไม่มีมวลไม่มีประจุมีอำนาจผ่านทะลุสูงถูกกั้นได้โดยแผ่นตะกั่วหนา
ค.ศ. 1911 (พ.ศ. 2454) Lord Emest Ruthertford และฮันส์ ไกเกอร์ (Hans Geiger) และเออร์เนสต์ มาร์สเดน (Emest Marsden) ร่วมกันทดลองเกี่ยวกับทิศทางของการเคลื่อนที่ของอนุภาคแอลฟาที่ประเทศอังกฤษในการทดลอง Rutherford ได้ใช้อนุภาคแอลฟายิงไปยังแผ่นโลหะทองคำบางๆและใช้ฉากเรืองแสง ZnS เป็นฉากรับดังรูป
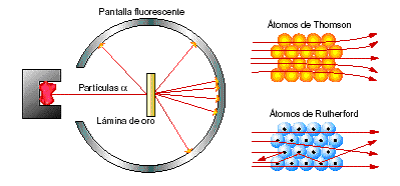
ภาพที่ 1 แสดงการทดลองการยิงอนุภาคแอลฟาไปยังแผ่นทองคำ
ที่มา : http://www.100ciaquimica.net/temas/tema3/ipunto2d.htm
จากผลการทดลองการตรวจสอบทิศทางของอนุภาคแอลฟาจะใช้ฉากเรืองแสงที่ทำด้วยซิงค์ซัลไฟด์เมื่ออนุภาคแอลฟากระทบกับฉากจะปรากฏแสงสว่างแวบขึ้นจากการทดลองพบว่าอนุภาคแอลฟาส่วนมากจะวิ่งผ่านแผ่นทองคำไปกระทบฉากเรืองแสง และมีอนุภาคแอลฟาจำนวนหนึ่งเบนออกจากเส้นตรงทำให้เกิดการเรืองแสงที่ด้านข้างและบางส่วนแสงเบนมาด้านหน้า
จากการทดลองของ Rutherford ไม่สามารถใช้แบบจำลองของ Thomson อธิบายได้เพราะตามแบบจำลองอะตอมของ Thomson อะตอมของแผ่นทองคำจะมี proton และ electron กระจายอยู่ทั่วทั้งอะตอมถ้าแบบจำลองอะตอมของ Thomson ถูกต้องเมื่อยิงอนุภาคแอลฟาที่มีประจุบวกเข้าไปในแผ่นทองคำอนุภาคของแอลฟาจะทะลุผ่านแผนทองคำและเกิดการเรืองแสงที่จุด A เท่านั้นและต้องไม่เกิดการเรืองแสงที่จุด A และ C
แต่จากผลการทดลองของ Rutherford ปรากฏว่าอนุภาคแอลฟาส่วนใหญ่วิ่งผ่านแผนทองคำเป็นตรงและมีส่วนที่เบี่ยงเบนออกและบางส่วนสะท้อนกลับแสดงว่าแบบจำลองของ Thomson ไม่สอดคล้องกับผลการทดลอง Rutherford อธิบายผลการทดลองดังนี้
- การที่อนุภาคแอลฟาส่วนใหญ่วิ่งผ่านทองคำเป็นเส้นตรงแสดงว่าอะตอมไม่ใช่ของแข็งทึบตันแต่ภายในอะตอมมีที่ว่างอยู่มาก(ผลการทดลองจุด A เป็นจุดที่รังสีแอลฟาผ่านช่องว่างในอะตอมไปยังฉากมากจุดนี้เรืองแสงมากแสดงว่าอะตอมมีช่องว่างมาก)
- อนุภาคแอลฟาบางอนุภาคที่หักเหออกจากทางเดิมเพราะภายในอะตอมมีอนุภาคที่มีมวลมากและมีประจุเป็นบวกสูงมีขนาดเล็กดังนั้นเมื่ออนุภาคแอลฟาเข้าใกล้อนุภาคนี้จะถูกผลักให้เบนออกจากทางเดิมหรือเมื่ออนุภาคแอลฟากระทบโดยตรงก็เกิดการสะท้อนกลับ(เกิดการเรืองแสงที่จุด B และ C)
ดังนั้นเพื่ออธิบายผลการทดลอง Rutherford จึงเสนอแบบอะตอมขึ้นมาใหม่ดังนี้ “อะตอมประกอบด้วยโปรตรอนซึ่งรวมตัวเป็นนิวเคลียสอยู่ตรงกลางนิวเคลียสมีขนาดเล็กมากแต่มีมวลมากและมีประจุบวกส่วน electron ที่มีประจุลบและมีมวลน้อยมากวิ่งอยู่รอบๆนิวเคลียสเป็นบริเวณกว้าง”
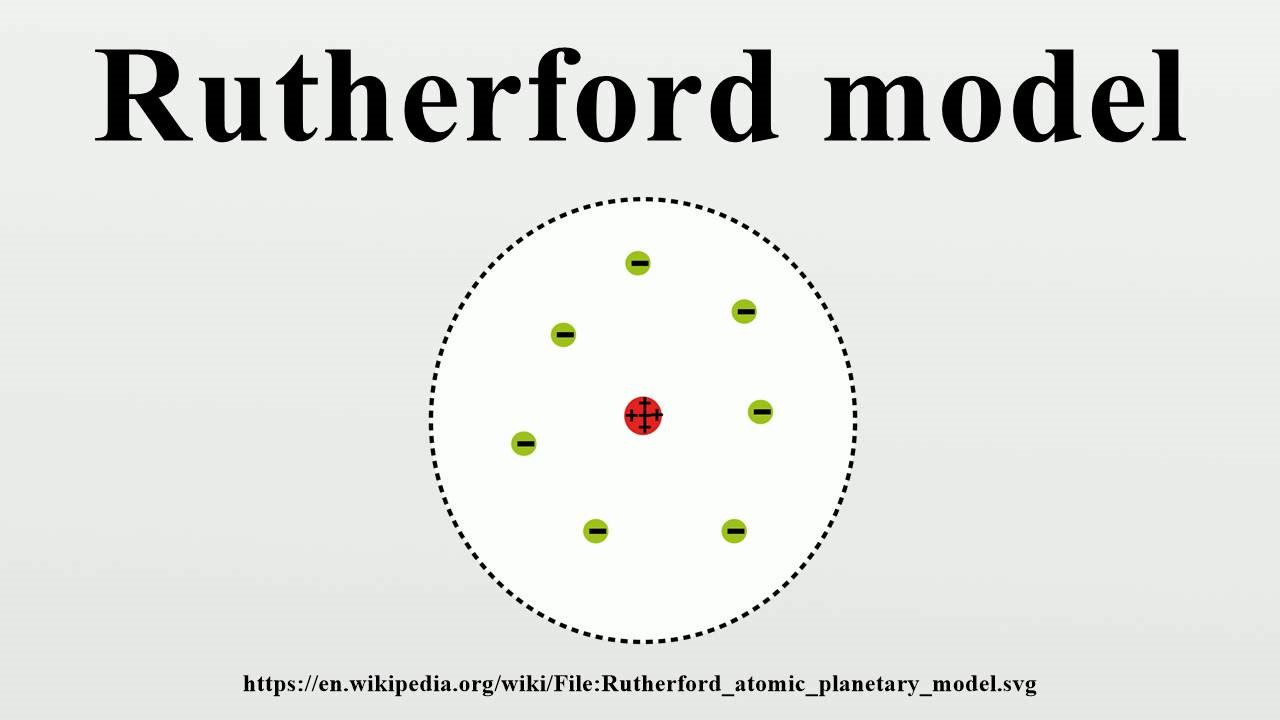
ภาพที่ 2 แสดงแบบจำลองอะตอมของรัทเทอร์ฟอร์ด (Rutherford)
ที่มา : http://en.wikipedia.org/wiki/File:Rutherford_atomic_planetary_model.svg
กลับไปที่เนื้อหา
แบบจำลองอะตอมของโบร์
นีล โบร์ เป็นคนแรกที่อธิบายว่าอิเล็กตรอนไม่แผ่คลื่นแม่เหล็กไฟฟ้าเมื่อโคจรรอบนิวเคลียส โดยเสนอว่า อิเล็กตรอนสามารถโคจรแบบไม่ตกใส่นิวเคลียสได้ที่บางวงจร เป็นวงจรที่เสถียร ในกรณีที่มีการเปลี่ยนวงโคจรเท่านั้นที่จะมีการปล่อยพลังงานออกมาเป็นโฟตอน (คลื่นแม่เหล็กไฟฟ้าที่เป็นอนุภาค) ซึ่งเป็นที่มาของสเปกตรัมของธาตุต่าง ๆ สเปกตรัมของอะตอมนี้สามารถอธิบายได้อย่างดีโดยใช้แบบจำลองอะตอมของโบร์
ก่อนยุคของโบร์เป็นที่ทราบกันก่อนแล้วว่า เมื่อให้พลังงานกับสาร อะตอมแต่ละชนิดจะส่งเส้นแสงที่เป็นเอกลักษณ์ของอะตอมแต่ละชนิดออกมา เส้นแสงเหล่านี้เป็นชุดเรียกว่า สเปกตรัม ซึ่งจากการศึกษาโดยนักเคมีและนักฟิสิกส์ สรุปเป็นสมการที่ได้จากการทดลอง โดยเริ่มต้นในปี 1885 บาล์มเมอร์ได้เสนอสูตรโดยประมวลจากข้อมูลการศึกษาสเปกตรัมไฮโดรเจน
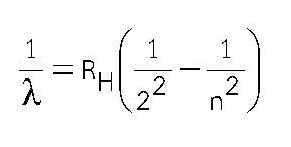
โดยที่ n = 3, 4, 5, ….. และ RH = 1.0973732 x 107 m-1 (ค่าคงที่ของริดจ์เบิร์ก)
สเปกตรัมชุดต่าง ๆ ของอะตอมไฮโดรเจนภายหลังสูตรของบาล์มเมอร์ มีการเสนอสูตรของชุดสเปกตรัมอื่น ๆ ดังนี้

โบร์ได้ใช้ทฤษฎีควอนตัมในการอธิบายสเปกตรัมที่เกิดจากอะตอมของไฮโดรเจน สมมติฐานของโบร์คือ อิเล็กตรอนเคลื่อนที่เป็นวงรอบโปรตรอน โดยมีเพียงบางวงโคจรเท่านั้นที่จะเสถียร พลังงานแต่ละระดับ (En) เป็นรัศมีวงโคจร (rn) มีค่า
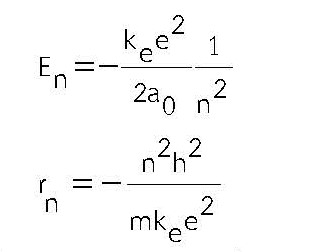
โดยที่ n = 1, 2, 3, ….. เมื่อ n = 1 เป็นวงโคจรที่มีขนาดเล็กที่สุด เรียกว่า รัศมีของโบร์ (Bohr Radius, a0 ) มีค่า 0.0529 nm
ระดับพลังงานในสุด (n = 1 ) จะเป็นระดับที่มีพลังงานต่ำสุด และถัดออกมาจะเป็นระดับที่มีพลังงานมากขึ้นเรื่อย ๆ และปกติอิเล็กตรอนชอบที่จะอยู่ชั้นในสุด (n = 1 ) เพราะจะมีเสถียรภาพมากที่สุด ภาวะเช่นนี้เรียก สภาวะพื้น (Ground State) หากอิเล็กตรอนได้รับพลังงานที่เหมาะสม อิเล็กตรอนจะดูดพลังงานนั้นแล้วเคลื่อนย้ายจากระดับพลังงานต่ำขึ้นไประดับพลังงานสูงกว่าเดิม เรียกภาวะเช่นนี้ว่าเป็นสภาวะกระตุ้น (Excited State) แต่ภาวะถูกกระตุ้นนี้อิเล็กตรอนจะมีพลังงานมากเกินไปจึงไม่เสถียร อิเล็กตรอนจะคายพลังงานส่วนหนึ่งออกมาแล้วเคลื่อนย้ายลงมาอยู่ในระดับพลังงานที่ต่ำกว่าเดิม พลังงานที่อิเล็กตรอนคายออกมาจะอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้าเสมอ
การแผ่คลื่นแม่เหล็กไฟฟ้าเกิดขึ้นเมื่ออิเล็กตรอนกระโดดเปลี่ยนวงโคจรสู่ระดับต่ำกว่า (ความแตกต่างระหว่างสถานะต้นกับสถานะปลาย) สเปกตรัมที่เกิดขึ้นทุกชุกสามารถทำนายได้ด้วยสูตรจากแบบจำลองอะตอมของโบร์ ซึ่งสอดคล้องกับสูตรจากการทดลองทุกสูตรข้างต้น
ตัวอย่างการคายพลังงานของอิเล็กตรอนของอะตอมไฮโดรเจนเกิดเป็นสเปกตัมดังนี้
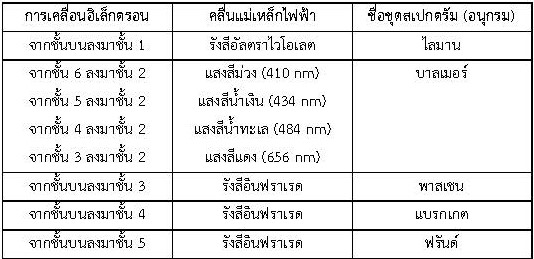
สรุปได้ว่า โบร์เสนอแบบจำลองอะตอมของไฮโดรเจนขึ้น โดยอาศัยความรู้เรื่องการเปลี่ยนแปลงพลังงานของอิเล็กตรอนและการเกิดสเปกตรัม โดยกล่าวว่า อะตอมไฮโดรเจนจะมีโปรตอน 1 ตัวอยู่ในนิวเคลียสตรงกลางอะตอม อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียส โดยมีแนวการเคลื่อนที่เป็นวงหลาย ๆ วง คล้ายวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว ระดับพลังงานในสุดจะเรียกระดับ K ถัดออกมาจะเรียกเป็นระดับ L , M , N , ….. ตามลำดับ ต่อมาได้มีการใช้ตัวเลขแสดงระดับพลังงาน n = 1 หมายถึง ระดับพลังงานที่ 1 คือชั้นในสุดและถัดออกมาจะเป็นชั้น n = 2 , n = 3 , … ตามลำดับ
ภาพที่ 1 แสดงแบบจำลองอะตอมของนีล โบร์ ( Niels Bohr)
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1357
ข้อบกพร่องของแบบจำลองอะตอมของโบร์คือ เขาตอบไม่ได้ว่าเหตุใดจึงมีบางวงโคจรที่เสถียร จนกระทั่งเดอบรอยล์ ได้เสนอแนวคิดว่า อิเล็กตรอนที่โคจรรอบนิวเคลียสในแบบจำลองอะตอมของโบร์ มีพฤติกรรมเป็นคลื่นนิ่งมีความถี่ที่ไม่ต่อเนื่อง (ดังกรณีคลื่นนิ่งในเชือก) คลื่นนิ่งของอิเล็กตรอน (เป็นวงปิดพอดี)
จะเกิดขึ้นเมื่อ 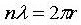
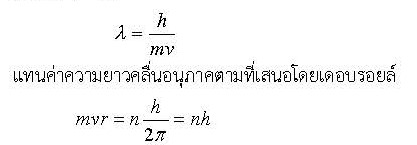
แทนค่าความยาวคลื่นอนุภาคตามที่เสนอโดยเดอบรอยล์
เงื่อนไขนี้เป็นกรณีของวงโคจรที่เสถียรนั่นคือโมเมนตัมเชิงมุมในแบบจำลองของโบร์มีค่าไม่ต่อเนื่อง แบบจำลองของโบร์นี้อธิบายได้ดีกว่าแบบจำลองของรัทเทอร์ฟอร์ด และสามารถอธิบายสเปกตรัมของอะตอมได้เป็นอย่างดี นอกจากนี้การใช้ทฤษฎีควอนตัมยังอธิบายสเปกตรัมของ X-ray ได้ด้วย
กลับไปที่เนื้อหา



