ขัดระเบียบกลุ่มธาตุ
จัดระเบียบกลุ่มธาตุ
วิวัฒนาการตารางธาตุ
ตารางธาตุ หมายถึง ตารางที่นักวิทยาศาสตร์จัดทำขึ้นเพื่อรวบรวมธาตุต่าง ๆ เอาไว้ด้วยกันให้เป็นหมวดหมู่เพื่อสะดวกในการศึกษา ก่อนมาเป็นตารางธาตุในปัจจุบัน ตารางธาตุได้มีวิวัฒนาการแบบต่างๆ สรุปได้โดยย่อ ดังนี้
ปี พ.ศ.2360 (ค.ศ.1817) โยฮันน์ เดอเบอไรเนอร์ (Johann Wolfgang Dobereiner) นักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆ ละ 3 ธาตุ ตามสมบัติที่คล้ายคลึงกัน เรียกว่า ชุดสาม (Triad) และพบว่า ธาตุกลางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ
ตัวอย่างธาตุชุดสามของเดอเบอไรเนอร์ เช่น
Li มวลอะตอม = 7.0
Na มวลอะตอม = 23
K มวลอะตอม = 39.1
แต่กฎนี้ใช้ได้กับธาตุบางหมู่เท่านั้น จึงไม่เป็นที่ยอมรับกัน

ภาพที่ 1 แสดงตารางธาตุในปัจจุบัน
ที่มา : http://www.rmutphysics.com/charud/virtualexperiment/virtual2/periodic/periodic2/table70.html
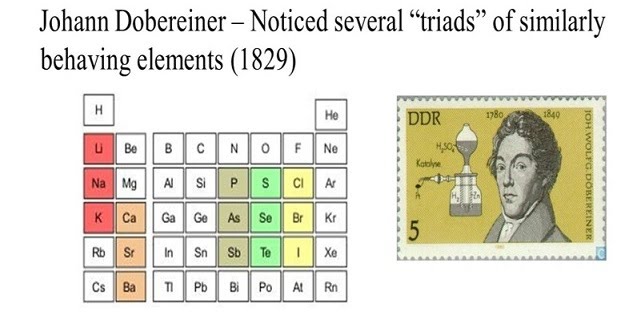
ภาพที่ 2 แสดงแนวคิดการจัดตารางธาตุของโยฮันน์ เดอเบอไรเนอร์
ที่มา : https://sites.google.com/site/elementandcompound/periodictable/evolution
ปี พ.ศ. 2407 (ค.ศ.1864) จอห์น อเล็กซานเดอร์ รีนา นิวแลนด์ส (John Alexander Reina Newlands) นักเคมีชาวอังกฤษพบว่าถ้านำธาตุมาเรียงตามมวลอะตอม จากน้อยไปมากแล้ว จะพบว่าธาตุที่ 8 จะมีสมบัติทางเคมีและกายภาพ คล้ายธาตุที่ 1 และจะเกิดขึ้นทุกๆ ช่วงของธาตุที่ 8 เรียกการจัดนี้ว่า Law of Octaves กฎนี้ไม่เป็นที่ยอมรับ เนื่องจากไม่สามารถอธิบายได้ว่า มวลอะตอมกับสมบัติที่คล้ายกันของธาตุนั้นมีความสัมพันธ์กันอย่างไร และกฎนี้ใช้ได้ถึงแคลเซียม (Ca) ที่มีมวลอะตอม 40 เท่านั้น
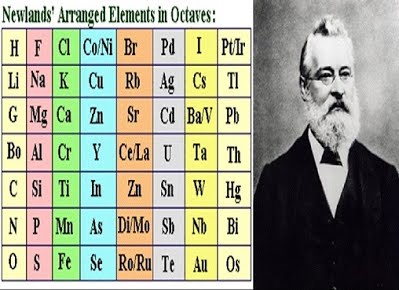
ภาพที่ 3 แสดงตารางธาตุตามแนวคิดของจอห์น อเล็กซานเดอร์ รีนา นิวแลนด์ส
ที่มา : https://sites.google.com/site/elementandcompound/periodictable/evolution
ปี พ.ศ. 2412 – 2413 (ค.ศ. 1869 – 1870) ดิมิทรี อิวาโนวิช เมนเดเลเอฟ (DmiTri Ivanovich Mendeleev) นักเคมีชาวรัสเซียได้เสนอกฎที่เรียกว่า กฎพิริออดิก ซึ่งเป็นกฎที่สำคัญทางเคมีเกี่ยวกับการจัดตารางธาตุ
กฏพิริออดิก กล่าวว่า ถ้าจัดเรียงธาตุตามมวลอะตอมของธาตุต่าง ๆ จากน้อยไปมากธาตุที่มีสมบัติคล้ายกันจะปรากฎซ้ำกันและอยู่ตรงกันเป็นช่วง ๆ
จากกฎพิริออดิก เมนเดเลเอฟ จึงจัดตารางธาตุขึ้น เรียกว่า ตารางพิริออดิกของเมนเดเลเอฟ เมนเดเลเอฟได้นำธาตุมาเรียงกันตามมวลอะตอม โดยเว้นที่ว่างสำหรับธาตุที่ยังไม่พบในขณะนั้น แต่คาดว่าน่าจะมีธาตุที่มีสมบัติตามตำแหน่งนั้นอยู่ ต่อมาภายหลังได้มีการค้นพบธาตุมากขึ้น ก็พบว่าถ้ายึดหลักการเรียงตามมวลอะตอมของเมนเดเลเอฟอย่างเคร่งครัด จะไม่สามารถทำให้ธาตุบางชนิดที่มีสมบัติคล้ายกันอยู่ในหมู่เดียวกันได้ จึงต้องสลับที่ของธาตุบางตัว แต่เมนเดเลเอฟก็ไม่สามารถอธิบายได้ว่า เพราะเหตุใดจึงต้องจัดเรียงธาตุเช่นนั้น นักวิทยาศาสตร์รุ่นต่อมาจึงเกิดแนวความคิดว่า ตำแหน่งของธาตุในตารางธาตุไม่น่าจะขึ้นอยู่กับมวลอะตอมของธาตุ แต่น่าจะขึ้นกับสมบัติอื่นที่มีความสัมพันธ์กับมวลอะตอม
ต่อมาปี พ.ศ. 2546 (ค.ศ.1913) เฮนรี่ กวิน เจฟฟรีส์ โมสลีย์ (Henry Gwyn Jeffreys Moseley) พบว่าการเรียงธาตุตามเลขอะตอม (จำนวนโปรตอนหรืออิเล็กตรอน) จะสอดคล้องกับกฎพิริออดิกโดยไม่ต้องสลับที่ธาตุกันเหมือนการเรียงตามมวลอะตอม และได้นำมาใช้การจัดตารางธาตุในปัจจุบัน ตารางธาตุในปัจจุบัน เป็นตารางที่พัฒนาจากตารางพิริออดิกของเมนเดเลฟ เรียงธาตุตามเลขอะตอม ซึ่งลักษณะการจัดเป็นแถวในแนวตั้ง เรียกว่า หมู่ (group) มีทั้งหมด 18 แถว และการจัดแนวนอน เรียกว่า คาบ (period) ซึ่งมีทั้งหมด 7 คาบ
ตารางธาตุในปัจจุบันสามารถแบ่งได้ดังนี้
การแบ่งธาตุในแนวตั้ง (หมู่) หมู่ (group) ธาตุในแนวตั้ง แบ่งออกเป็นกลุ่มย่อย A กับ B
กลุ่ม A มี 8 หมู่ คือ หมู่ IA ถึง VIIIA
หมู่ IA มีชื่อเรียกว่า โลหะแอลคาไล (Alkali metals) ประกอบด้วย Li ลิเทียม (Lithium), Na โซเดียม (Sodium - Natrium), K โพแทสเซียม (Potassium - Kalium), Rb รูบิเดียม (Rubidium), Cs ซีเซียม (Cesium), Fr แฟรนเซียม (Francium)
หมู่ IIA มีชื่อเรียกว่า โลหะแอลคไลน์เอิร์ท (Alkaline earth metals) ประกอบด้วย Be เบริลเลียม (Beryllium), Mg แมกนีเซียม (Magnesium), Caแคลเซียม (Calcium), Sr สตรอนเทียม (Strontium), Ba แบเรียม (Barium), Ra เรเดียม (Radium)
หมู่ IIIA ประกอบด้วยBโบรอน (Boron), Al อะลูมิเนียม (Aluminium), Ga แกลเลียม (Gallium), In อินเดียม (Indium), Tl แทลเลียม (Thallium)
หมู่ IVA ประกอบด้วย C คาร์บอน (Carbon), Si ซิลิกอน (Silicon), Ge เจอร์เมเนียม (Germanium), Sn ดีบุก (Tin - Stannum), Pb ตะกั่ว (Lead - Plumbum)
หมู่ VA ประกอบด้วย N ไนโตรเจน (Nitrogen), P ฟอสฟอรัส (Phosphorous), As อะซินิค (สารหนู) (Arsenic), Sb พลวง (Antimony - Stibium), Bi บิสมัท (Bismuth)
หมู่ VIA มีชื่อเรียกว่า คาลโลเจน ประกอบด้วย O ออกซิเจน (Oxygen), S ซัลเฟอร์ (กำมะถัน) (Sulfur), Se ซีลีเนียม (Selenium), Te เทลลูเรียม (Telllurium), Po โพโลเนียม (Polonium)
หมู่ VIIA มีชื่อเรียกว่า แฮโลเจน (Halogens) ประกอบด้วย F ฟลูออรีน (Fluorine), Cl คลอรีน (Chlorine), Br โบรมีน (Bromine), I ไอโอดีน (Iodine), At แอสทาทีน (Astatine)
หมู่ VIIIA มีชื่อเรียกว่า แก๊สเฉื่อยหรือแก๊สมีตระกูล (Inert gases or nobel gases) ประกอบด้วย He ฮีเลียม (Helium), Ne นีออน (Neon), Ar อาร์กอน (Argon), Kr คริปตอน (Krypton), Xe ซีนอน (Xenon), Rn เรดอน (Radon)
กลุ่ม B มี 8 หมู่ คือ IB ถึง VIIIB แต่ใน VIIIB จะมี 3 แถว ธาตุกลุ่ม B ทั้งหมดเรียกว่ากลุ่ม “ธาตุแทรนซิซัน (Transition elements)”
การแบ่งธาตุในแนวนอน (คาบ)
คาบที่ 1 มี 2 ธาตุ คือ H , He
คาบที่ 2 มี 8 ธาตุ คือ ตั้งแต่ Li ถึง Ne
คาบที่ 3 มี 8 ธาตุ คือ ตั้งแต่ Na ถึง Ar
คาบที่ 4 มี 18 ธาตุ คือ ตั้งแต่ K ถึง Kr
คาบที่ 5 มี 18 ธาตุ คือ ตั้งแต่ Rb ถึง Xe
คาบที่ 6 มี 32 ธาตุ มี 2 กลุ่ม
- กลุ่มแรก 18 ธาตุ คือ ตั้งแต่ Cs ถึง Rn
- กลุ่มที่ 2 เรียกว่า กลุ่มธาตุแลนทาไนด์ (Lanthanide series) คือ ตั้งแต่ Ce ถึง Lu
คาบที่ 7 มี 29 ธาตุ มี 2 กลุ่ม
- กลุ่มแรก 18 ธาตุ คือ ตั้งแต่ Fr ถึง Uuo
- กลุ่มที่ 2 เรียกว่า กลุ่มธาตุแอกทิไนด์ (Actinide series) คือ ตั้งแต่ Th ถึง Lr
แหล่งที่มา :
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์องค์ประกอบพื้นฐานทางเคมี. กรุงเทพฯ: เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนวิทยาศาสตร์พื้นฐาน ชั้นมัธยมศึกษาปีที่ 2 เล่ม 1 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
ศรีลักษณ์ พลวัฒนะ, และคณะ.(2551). หนังสือเรียนเสริมฯ สารและสมบัติของสาร ม.4-6 ช.4 สำนักพิมพ์แม็ค บจก. สนพ.
นักเรียน
-
9427 ขัดระเบียบกลุ่มธาตุ /lesson-chemistry/item/9427-2018-11-14-08-42-18เพิ่มในรายการโปรด
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.) กระทรวงศึกษาธิการ เป็นหน่วยงานของรัฐที่ไม่แสวงหากำไร ได้จัดทำเว็บไซต์คลังความรู้ SciMath เพื่อส่งเสริมการสอนวิทยาศาสตร์ คณิตศาสตร์และเทคโนโลยีทุกระดับการศึกษา โดยเน้นการศึกษาขั้นพื้นฐานเป็นหลัก หากท่านพบว่ามีข้อมูลหรือเนื้อหาใด ๆ ที่ละเมิดทรัพย์สินทางปัญญาปรากฏอยู่ในเว็บไซต์ โปรดแจ้งให้ทราบเพื่อดำเนินการแก้ปัญหาดังกล่าวโดยเร็วที่สุด
The Institute for the Promotion of Teaching Science and Technology (IPST), Ministry of Education, a non-profit organization under the Thai government, developed SciMath as a website that provides educational resources in Science, Mathematics and Technology. IPST invites visitors to use its online resources for personal, educational and other non-commercial purpose. If there are any problems, please contact us immediately.
Copyright © 2018 SCIMATH :: คลังความรู้ SciMath. Terms and Conditions. Privacy. , All Rights Reserved.
อีเมล: This email address is being protected from spambots. You need JavaScript enabled to view it. (ให้บริการในวันและเวลาราชการเท่านั้น)