โครงสร้างอะตอม
อะตอม ( Atom ) เป็นหน่วยพื้นฐานของสสาร ที่ประกอบไปด้วยส่วนของนิวเคลียสที่หนาแน่นมากตรงจุดศูนย์กลางล้อมรอบด้วยกลุ่มหมอกของอิเล็กตรอนที่มีประจุลบ นิวเคลียสมีประจุบวกประกอบด้วยอนุภาค โปรตอนที่มีประจุบวก และนิวตรอนซึ่งเป็นกลางทางไฟฟ้า อิเล็กตรอนของอะตอมถูกดึงดูดให้อยู่กับนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า
ภาพที่ 1 แบบจำลองโครงสร้างอะตอมของลิเทียม ( 3Li )
ที่มา: https://pixabay.com, Geralt
นั่นคือนิยามของอะตอม ที่บอกว่ามันมีประกอบด้วยอนุภาคพื้นฐาน 3 ชนิด ได้แก่ โปรตอน นิวตรอน และอิเล็กตรอน แต่น้อง ๆ ทราบไหมว่า กว่าจะได้เป็นนิยามข้างต้นมา นักวิทยาศาสตร์ได้ทำการศึกษาเกี่ยวกับอะตอมนี้มาเป็นระยะเวลากว่า 2,000 ปี โดยการศึกษาเกี่ยวกับอะตอมนั้นเริ่มจาก ดิโมคริตุส ( Democritus ) นักปราชญ์ชาวกรีกที่มีชีวิตอยู่ในช่วง พ.ศ. 83 -173 เชื่อว่าถ้าแบ่งสารให้มีขนาดเล็กลงเรื่อย ๆ ในที่สุดก็จะได้หน่วยย่อยซึ่งไม่สามารถแบ่งให้เล็กลงได้อีก เรียกหน่วยย่อยนี้ว่า อะตอม
เซอร์ จอห์น ดอลตัน ( Sir John Dalton ) นักวิทยาศาสตร์ชาวอังกฤษที่มีชีวิตอยู่ในช่วง พ.ศ. 2309-2387 เป็นคนแรกที่เสนอทฤษฎีอะตอม ที่รู้จักกันในชื่อ ทฤษฎีอะตอมของดอลตัน ซึ่งมีสาระสำคัญดังนี้
- ธาตุประกอบด้วยอนุภาคเล็กๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน และมีสมบัติแตกต่างจากอะตอมของธาตุอื่น
- สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อย ๆ
ภาพที่ 2 แบบจำลองอะตอมของดอลตัน
ที่มา: www.scimath.org/ebook/sci/เคมีเพิ่มเติม-เล่ม1-ม.4-6/index.html
ทฤษฎีอะตอมของดอลตันช่วยให้นักวิทยาศาสตร์สมัยนั้นสามารถอธิบายลักษณะและสมบัติของอะตอมได้ระดับหนึ่ง ต่อมาเมื่อมีการศึกษาเกี่ยวกับอะตอมเพิ่มขึ้น และค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับแนวคิด นักวิทยาศาสตร์รุ่นต่อมาจึงได้ศึกษาเพิ่มเติมและสร้างแบบจำลองขึ้นมาใหม่
ออยเกน โกลด์ชไตน์ ( Eugen Goldstein ) นักวิทยาศาสตร์ชาวเยอรมันที่มีชีวิตในช่วง พ.ศ. 2393 - 2473 ค้นพบรังสีที่มีประจุบวก จากการดัดแปลงหลอดรังสีแคโทด โดยทำการทดลองกับแก๊สหลายชนิด พบว่าอนุภาคที่มีประจุบวกเหล่านี้มีอัตราส่วนประจุต่อมวล ( e/m ) ไม่คงที่ แต่ถ้าบรรจุแก๊สไฮโดรเจนไว้ในหลอดรังสีแคโทด จะได้อนุภาคที่มีประจุไฟฟ้าบวกเท่ากับประจุไฟฟ้าลบ ซึ่งต่อมาเรียกอนุภาคบวกที่เกิดจากแก๊สไฮโดรเจนนี้ว่า โปรตอน
เซอร์ โจเซฟ จอห์น ทอมสัน ( พ.ศ. 2399 - 2483 ) ได้ทำการทดลองเพิ่มขั้วไฟฟ้า 2 ขั้วในแนวดิ่ง กับหลอดรังสีแคโทดที่ดัดแปลง พบว่าตำแหน่งของจุดสว่างเบนเข้าหาขั้วบวกของสนามไฟฟ้า และเมื่อเปลี่ยนชนิดของแก๊สที่บรรจุในหลอดและโลหะที่ใช้เป็นแคโทด พบว่ารังสีที่เกิดขึ้นยังคงเบนเข้าหาขั้วบวกเหมือนเดิม เมื่อคำนวณหาอัตราส่วนประจุต่อมวล พบว่าได้ค่าเท่ากับ 1.76 x 108 คูลอมบ์ต่อกรัม ทุกครั้งโดยไม่ขึ้นกับชนิดของแก๊สที่ใช้ จากผลการทดลองและการคำนวณนี้ช่วยให้ทอมสันสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่เป็นประจุลบเป็นองค์ประกอบ อนุภาคนี้เรียกว่า อิเล็กตรอน
จากผลการทดลองของ โกลด์ชไตน์ และ ทอมสัน ทำให้ได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงเสนอแบบจำลองอะตอมของทอมสัน ว่า “อะตอมเป็นรูปทรงกลมประกอบด้วยเนื้ออะตอมซึ่งมีประจุบวกและมีอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไป อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ”
ภาพที่ 3 แบบจำลองอะตอมของทอมสัน
ที่มา: ศุภาวิตา จรรยา
แบบจำลองอะตอมของทอมสัน นับเป็นก้าวสำคัญเกี่ยวกับการศึกษาเรื่องอะตอมต่อจากดอลตัน และถือได้ว่าทอมสันเป็นคนแรกที่เสนอรายละเอียดภายในอะตอม ทำให้ได้มโนภาพของอะตอมชัดขึ้น อย่างไรก็ตามในเวลาต่อมา เมื่อมีการศึกษาทดลองเกี่ยวกับอะตอมมากขึ้น แบบจำลองอะตอมของทอมสันไม่สามารถอธิบายโครงสร้างของอะตอมได้อย่างครอบคลุม
ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด และ ฮันส์ ไกเกอร์ นักวิทยาศาสตร์ชาวเยอรมันได้ศึกษาและพิสูจน์แบบจำลองอะตอมของทอมสัน เมื่อปี พ.ศ. 2454 โดยการยิงอนุภาคแอลฟาซึ่งมีประจุบวกไปยังแผ่นทองคำบาง ๆ และใช้ฉากเรืองแสงที่เคลือบด้วยซิงค์ซัลไฟด์โค้งเป็นวงล้อมรอบด้วยแผ่นทองคำเพื่อตรวจจับอนุภาคแอลฟา จากผลการทดลองพบว่า ส่วนใหญ่จะเกิดการเรืองแสงบนฉากที่อยู่บริเวณด้านหลังของแผ่นทองคำ มีบางครั้งที่เกิดการเรืองแสงบริเวณด้านข้าง และมีน้อยครั้งที่เกิดการเรืองแสงบริเวณด้านหน้า ดังภาพที่ 4
ภาพที่ 4 การทดลองของรัทเทอร์ฟอร์ด
ที่มา: www.scimath.org/ebook/sci/เคมีเพิ่มเติม-เล่ม1-ม.4-6/index.html
จากการทดลองนี้ ถ้าอธิบายตามแบบจำลองของทอมสัน อนุภาคแอลฟา ซึ่งมีประจุบวกก็ต้องผลักกับโปรตอนทำให้เกิดการเบี่ยงเบนไปจากแนวเส้นตรงได้บ้าง แต่ไม่น่าจะมีอนุภาคสะท้อนกลับมากระทบฉากบริเวณด้านหน้าได้ ดังนั้น รัทเทอร์ฟอร์ดอธิบายว่า แสดงว่าในอะตอมน่าจะมีอนุภาคที่มีมวลสูงมากกว่าอนุภาคแอลฟา และมีประจุบวก จึงได้เสนอแบบจำลองอะตอมใหม่ว่า “อะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กมากอยู่ภายใน และมีประจุไฟฟ้าเป็นบวก โดยมีอิเล็กตรอนวิ่งอยู่รอบ ๆ” ดังภาพที่ 5
ภาพที่ 5 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ที่มา: ศุภาวิตา จรรยา
เมื่อกล่าวมาถึงตรงนี้ จะเห็นว่าการศึกษาเกี่ยวกับอะตอม ทำให้นักวิทยาศาสตร์ทราบว่าในอะตอมประกอบด้วย อิเล็กตรอนและโปรตอน ตามแบบจำลองของรัทเทอร์ฟอร์ด มวลอะตอมคือมวลของนิวเคลียส ถ้านิวเคลียสประกอบด้วยโปรตอนอย่างเดียว มวลของนิวเคลียสก็น่าจะเท่ากับมวลของโปรตอนรวมกัน แต่จากการทดลองพบว่า มวลของธาตุส่วนใหญ่มีค่าเป็นสองเท่า หรือมากกว่ามวลของโปรตอนทั้งหมดรวมกัน รัทเทอร์ฟอร์ดจึงสันนิษฐานว่า น่าจะมีอนุภาคอีกชนิดหนึ่งในนิวเคลียส และอนุภาคนั้นควรมีมวลใกล้เคียงกับมวลของโปรตอนและเป็นกลางทางไฟฟ้า และการทดลองของทอมสันในปี พ.ศ. 2456 ก็ได้สนับสนุนแนวคิดนี้เช่นกัน เมื่อเขาได้ศึกษาหามวลของอนุภาคบวกของแก๊สนีออนที่บรรจุในหลอดรังสีแคโทดพบว่า อนุภาคบวกมีมวล 2 ค่า คือ 20 และ 22 หน่วย นั่นแสดงว่านีออนประกอบด้วยอะตอม 2 ชนิดที่มีมวลไม่เท่ากัน
ต่อมาใน พ.ศ. 2475 เซอร์เจมส์ แซดวิก ได้ทดลองยิงอนุภาคแอลฟาไปยังอะตอมของธาตุต่าง ๆ และทดสอบผลการทดลองด้วยเครื่องมือที่มีความเที่ยงตรงสูง ทำให้มั่นใจว่า ในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าอยู่จริง และเรียกว่า นิวตรอน การค้นพบครั้งนี้ทำให้ความรู้เกี่ยวกับอะตอมชัดเจนว่า “อะตอมประกอบไปด้วยอนุภาคมูลฐาน 3 ชนิด คือ อิเล็กตรอน โปรตอน และนิวตรอน”
แต่แบบจำลองอะตอมของรัทเทอร์ฟอร์ด ยังไม่สามารถอธิบายได้ว่าอิเล็กตรอนอยู่รอบนิวเคลียสในลักษณะใด นักวิทยาศาสตร์จึงได้ศึกษาค้นคว้า ทดลอง จนได้แบบจำลองอะตอมของโบร์ว่า “อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสที่เป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดซึ่งมีพลังงานต่ำสุด เรียกว่า ระดับ K ระดับพลังงานที่อยู่ถัดมาเรียก L M N ตามลำดับ”
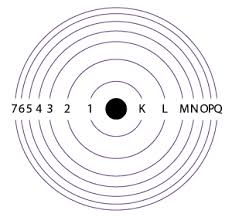
ภาพที่ 6 แบบจำลองอะตอมของโบร์
ที่มา: http:// thn2442555chemistry.blogspot.com/2016/08/blog-post_66.html
แต่แบบจำลองอะตอมของโบร์ยังมีข้อจำกัดที่ไม่สามารถอธิบายสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ นักวิทยาศาสตร์จึงได้ศึกษาค้นคว้า ทดลองเพิ่มเติมจนค้นพบแบบจำลองอะตอมแบบกลุ่มหมอก โดยแบบจำลองอะตอมแบบกลุ่มหมอกกล่าวไว้ว่า “ อิเล็กตรอนมีขนาดเล็กมากและเคลื่อนที่อย่างรวดเร็วตลอดเวลาไปทั่วทั้งอะตอม จึงไม่สามารถบอกตำแหน่งที่แน่นอนของอะตอมได้ อย่างไรก็ตามนักวิทยาศาสตร์พบว่ามีโอกาสที่จะพบอิเล็กตรอนรอบนิวเคลียสบางบริเวณเท่านั้น ทำให้สร้างมโนภาพได้ว่าอะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบ ๆ นิวเคลียส บริเวณที่กลุ่มหมอกทึบแสดงว่าโอกาสที่จะพบอิเล็กตรอนได้มากกว่าบริเวณที่มีกลุ่มหมอกจาง”
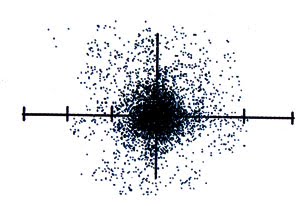
ภาพที่ 7 แบบจำลองอะตอมแบบกลุ่มหมอก
ที่มา: https://sites.google.com/a/tupr.ac.th/baeb-calxng-xatxm/baeb-calxng-xatxm-klum-hmxk
แบบจำลองอะตอมแบบกลุ่มหมอกสามารถอธิบายสมบัติต่าง ๆ ของอะตอมได้อย่ากว้างขวาง แต่นั่นก็ไม่ใช่เหตุผลในการยุติการศึกษาทดลองเกี่ยวกับอะตอม เพราะความรู้ทางวิทยาศาสตร์สามารถเปลี่ยนแปลงได้เมื่อมีหลักฐาน ประจักษ์พยาน หรือข้อมูลใหม่ ๆ ที่ใช้อธิบายปรากฏการณ์ได้ดีกว่า ดังนั้น ในอนาคตจึงอาจจะมีแบบจำลองอะตอมที่สามารถอธิบายโครงสร้างอะตอมได้เหมาะสมกว่าในปัจจุบันก็เป็นได้
แหล่งที่มา
ปุณยนุช หวังอนุตตร และคณะ. แบบจำลองอะตอม. สืบค้นเมื่อวันที่ 26 เมษายน 2562 .จาก https://sites.google.com/a/tupr.ac.th/baeb-calxng-xatxm/baeb-calxng-xatxm-klum-hmxk
สสวท. ( 2556 ). หนังสือเรียนรายวิชาเพิ่มเติมเคมี เล่ม 1 ( พิมพ์ครั้งที่ 5 ). กรุงเทพ: องค์การค้าของ สกสค.
อัคร สุทธิศักดิ์ศรี. แบบจำลองอะตอมของโบร์. สืบค้นเมื่อวันที่ 26 เมษายน 2562. จาก http:// thn2442555chemistry.blogspot.com/2016/08/blog-post_66.html








